
科目: 来源: 题型:
【题目】测得某溶液中含Cu2+ , K+ , SO42﹣ , Cl﹣四种离子且阳离子的个数比为:N(Cu2+):N(K+)=3:4,则SO42﹣与Cl﹣的物质的量之比可能是( )
A.3:2
B.1:3
C.1:8
D.2:5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,则所得混合气体的平均摩尔质量为_______。(保留一位小数)
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为____L。
Ⅱ. 标准状况下,用一定量的水吸收氨气后制得溶液浓度为17.0 mol·L-1,密度为0.90 g·mL-1的氨水,试计算1体积水吸收_______体积的氨气可制得上述氨水。(保留整数)
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何检验绿矾晶体中Fe2+是否被氧化?_______________________________
(2)已知本实验所用绿矾晶体没有被氧化。为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至装置A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量装置A的质量 f.冷却到室温
②根据实验记录,计算绿矾化学式中结晶水数目x=_____________(列式表示)。若实验时按a、d次序操作,则使x_____________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。
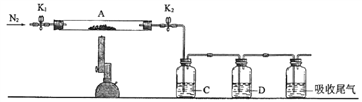
①C、D中的溶液依次为__________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_____________。
A.品红 B.NaOH C.BaCl2 D.Ba(NO3)2 E.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_______________。
(4)绿矾溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________(写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】制备氰氨基化钙的化学方程式为CaCO3+2HCN![]() CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A. 氢元素被氧化, 碳元素被还原
B. HCN被氧化, CaCO3被还原
C. HCN是氧化剂, CaCO3是还原剂
D. CaCN2是氧化产物, H2为还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH4+、Fe2+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g.
综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)该混合物中一定含有的离子__________;可能含有的离子__________。
(3)K+物质的量: n(K+)_____(具体值或取值范围)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com