
科目: 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目: 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
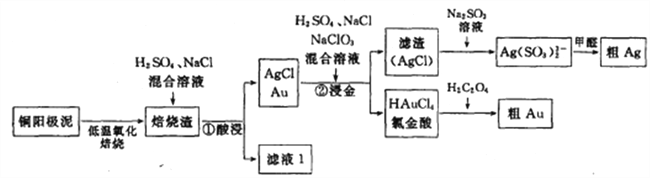
(1)氯金酸(HAuCl4)中的Au的化合价为________
(2)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________
(3)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________
(4)“②浸金”反应中,H2SO4的作用为_____,该步骤的分离操作中,需要对所得的AgCl进行水洗。简述如何判断AgCl已经洗涤干净?__________.
(5)氯金酸(HAuCl4)在PH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________
(6)甲醛还原法沉积银,通常是在搅拌下于室温及弱碱性条件下进行,甲醛被氧化为碳酸氢根离子,则该反应的离子方程式为______________电解法精炼银,用10A的电流电解30min,若电解效率(通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比)为80%,此时可得到银单质的质量为________。(保留1位小数,法拉第常数96500C/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 最外层都只有2个电子的X、Y原子,化学性质一定相似
B. 在所有的元素中,氟的电负性最大
C. 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种
D. 次氯酸分子的电子式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) ΔH3=+23.5 kJ/mol
2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)的△H=________.
CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。
①973 K时,测得:
NO2(g)![]() NO(g)+ 1/2O2(g) K1=0.018;
NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g)![]() SO3(g) K2=20;
SO3(g) K2=20;
则反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)的K3=________
SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为________。
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g)![]() SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是___________.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是____;Ⅱ中0~20min,用NO3-表示的平均反应速率为____mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]
查看答案和解析>>
科目: 来源: 题型:
【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A.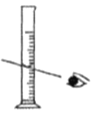 量取浓硫酸 B.
量取浓硫酸 B.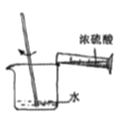 稀释浓硫酸 C.
稀释浓硫酸 C.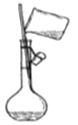 转移入容量瓶 D.
转移入容量瓶 D. 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
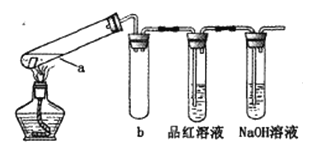
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com