
科目: 来源: 题型:
【题目】氮元素在地球上含量丰富,其中氨气在工农业生产生活中有着重要的作用。
(1)大气中氮以_________(填微粒符号)形式存在。固氮是氮循环的重要环节,工业固氮制NH3反应温度选择500℃左右的原因是________________________________。
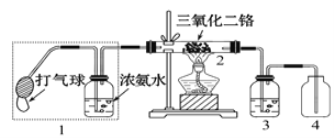
(2)某兴趣小组用如图装置探究氨的催化氧化,加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”)。
(3)上图中若取消3,在4中仅观察到大量白烟,该白烟的化学式可能为______________。
(4)实验室还可用浓氨水与氢氧化钠固体混合,制得氨气。请用平衡移动及其他相关的理论解释该方法能制备氨气的原因:_____________________________________________。
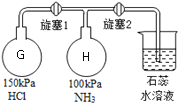
(5)按下图装置进行氨气的性质实验(旋塞1和旋塞2实验前关闭),G、H是两个等体积的容器。先打开旋塞1,一段时间后,关闭旋塞1,再打开旋塞2,H瓶中现象依次是:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH![]() CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。

(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤及硫酸工业尾气中的SO2是重要的大气污染物,可以用以下方法处理尾气中的SO2,
方法一:通过活性炭作用回收
2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
(1)上述反应的化学平衡常数表达式为 _____________________;若在某密闭容器中进行上述反应,为了加快吸收SO2,可采取的措施有_____________________________________。
方法二:利用亚硫酸钠溶液进行吸牧
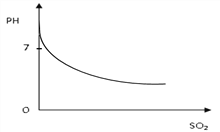
(2)把尾气(含二氧化硫)不断通入到饱和亚硫酸钠溶液中,生成亚硫酸氢钠,pH值的变化如图所示,请根据图示,解释PH值变化的原因:_______________________________________。
方法三:利用氯气和干燥的二氧化硫在活性炭催化剂存在下反应制取氯化硫酰:氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。
SO2(g)+Cl2(g)![]() SO2Cl2(l)+97.3kJ
SO2Cl2(l)+97.3kJ
(3)若反应的容器体积为2L,2分钟内液体质量增加了2.7克,用二氧化硫表示这两分钟内的化学反应速率______________________。
(4)若在此条件下,提高SO2的转化率,可采取的措施有____________________________________;当_________________________________________时说明上述反应已达到平衡状态。
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素R的最高价氧化物的水化物分子式是HnRO2n﹣2 , 则在气态氢化物中R元素的化合价是( )
A.3n﹣10
B.12﹣3n
C.3n﹣4
D.3n﹣12
查看答案和解析>>
科目: 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
请完成下列填空:
(1)写出一个包含上述体系中七种物质的氧化还原反应方程式(无需配平):_________________________;上述反应中,还原产物是_____________,每转移1 mol电子,生成Cl2 _____ L(标准状况)。
(2)上述反应体系中,有些短周期元素的简单离子核外电子排布相同,它们的简单离子半径由大到小的顺序为______________(用离子符号表达)。
(3)氯原子的最外层电子排布式为_____________________,氯原子核外共有____种不同运动状态的电子。
(4)在上述反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。比较该反应中的氧化剂和氧化产物的氧化性强弱_______>________。
(5)请用原子结构理论解释上述含7种物质的氧化还原反应体系中,属于同一主族两种元素非金属性的强弱,____>______;______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】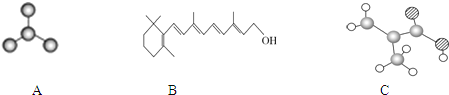
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称_____________。
②该有机物的同分异构体的二氯取代物有_____________种。
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为_____________。
②1mol维生素A最多可与_____________molH2发生加成反应。
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为_____________。
②该物质中所含官能团的名称为_________________和_________________。
(4)下列实验操作不正确的是_________________
A.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。
C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇
D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素符号 | 元素性质或原子结构 |
T | M层上的电子数是原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
下列叙述中不正确的是( )
A.14X可用与测定文物年代
B.Z的非金属性比T强
C.Y和T位于同一主族
D.X元素形成的化合物种类很多
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.金属性:Y>Z
B.离子的还原性:X>W
C.氢化物的沸点:X>W
D.离子半径:Z>Y>X
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.所有的原子核内都有质子和中子
B.(H+)实质上是一个裸露的质子
C.核外电子排布相同的微粒,其化学性质也相同
D.非金属元素原子最外层电子数都大于4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com