
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_____。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代半导体工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_____________
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,请回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O__________
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为___________
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
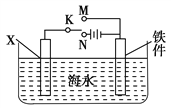
①开关K断开时,且若为生铁,则铁件主要发生_____腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质属于常见氧化剂的一组是( )
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、C,H2
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;![]() H2SO4(浓)+NaOH(aq)===
H2SO4(浓)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
A. 上述热化学方程式中的计量数表示分子数。
B. ΔH1>ΔH2
C. ΔH2应为![]() H2SO4(浓)溶于水的能量变化与中和热之和。
H2SO4(浓)溶于水的能量变化与中和热之和。
D. |ΔH1|〈|ΔH2|
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 在1 L0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
B. 常温常压下,Na2O2与足量H2O反应,生成4.48LO2,转移电子的数目为0.2NA
C. 在密闭容器中充入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA
D. 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
查看答案和解析>>
科目: 来源: 题型:
【题目】阿魏酸是用于治疗心脑血管疾病及白细胞减少等症药品的基本原料。下面是以石炭酸为原料制备阿魏酸的一种合成路线:
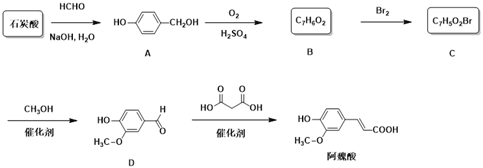
(1)由石炭酸生成A和A生成B的反应类型分别为____、______。
(2)阿魏酸有顺式和反式两种结构,其顺式结构的结构简式为________。
(3)C中官能团名称为__________。
(4)由B生成C的化学反应方程式为___________________。
(5)芳香化合物E是D的同分异构体,0.1 mol E能与饱和碳酸氢钠溶液反应放出4.4g CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为2∶2∶1∶3,写出符合要求的E的结构简式____________。
(6)由谷维素(![]() )也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
)也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图回答,下列说法正确的是
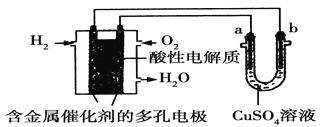
A. 此装置若用于铁表面镀铜时,a为铁。
B. 此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。
C. 燃料电池中正极反应为:O2+4e-+2H2O===4OH-
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种重要的化工原料,在生产生活中有着广泛的应用,某校研究性学习小组的同学学习完氮的有关性质之后,准备对氨的性质进行实验探究。
(1)实验室制取氨气的化学方程式为_________________________________。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”),理由是_________________________。
(3)该小组的同学设计了如下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
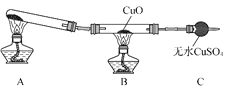
①利用装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。已知红色物质为一种单质,则氨气与CuO反应的化学方程式为________________。
②有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+―→Cu+Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O:______________。
(4)该小组的同学根据"侯氏制碱法"原理,进行碳酸氢钠的制备,有关反应为:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
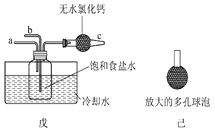
某同学用上图中戊装置(其他装置未画出)进行实验。
①实验时,须先从a管通入________气体(填化学式),然后从b管持续通入另一种气体。
②有同学建议在戊装置的b管下端连接己装置,理由是____________________。
③碳酸氢钠受热所得固体12.28 g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00 g,则所得固体中碳酸钠的质量分数为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,在溶液中可发生以下两个反应:①Cl2 + 2Br- = Br2 + 2Cl-;②Br2 + 2Fe2+ = 2Fe3+ + 2Br-。现将标准状况下 1.12L 的氯气通入 1L 0.05mol/L 的 FeBr2溶液中,由此判断下列说法正确的是
A. 氧化性强弱:Cl2 > Fe3+ > Br2 B. 还原性强弱:Br- >Fe2+ >Cl-
C. 反应后溶液中 c(Fe3+):c(Br- ) =1:1 D. 反应后溶液中 c(Fe2+):c(Cl-) =1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com