
科目: 来源: 题型:
【题目】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
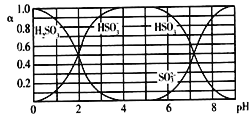
A. 溶液的pH=5时,硫元素的主要存在形式为HSO3-
B. 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 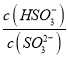 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林是一种历史悠久的解热镇痛药,对预防血栓和脑梗有很好的作用, M是一种防晒剂,它们的结构简式分别为:
![]() 和
和![]()
由A出发合成路线如下:

已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基; ![]()
②![]()
③E能与碳酸氢钠溶液反应产生气体;H能发生银镜反应
根据以上信息回答下列问题
(1)M中含氧官能团的名称____。阿司匹林的核磁共振氢谱中显示有____种不同化学环境的氢原子
(2)写出 H→Ⅰ过程中的反应类型________________。F的结构简式________________。
(3)写出D →E转化过程中①(D + NaOH)的化学方程式________________。
(4)阿司匹林有多种同分异构体,符合下列条件的所有同分异构体有______________种,其中苯环上的一氯代物有两种的结构简式______。(任写出一种)
a.苯环上有3个取代基
b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg
(5)写出由Ⅰ到M的合成路线(用流程图表示)。示例
![]() __________________
__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关周期表的说法正确的是( )
A.短周期是第一、二、三、四周期B.元素周期表有18个族
C.第IA族的元素全部是金属元素D.元素周期表含元素最多的族是副族
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
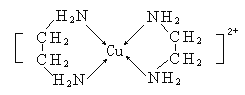
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
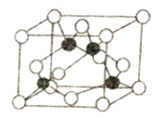
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
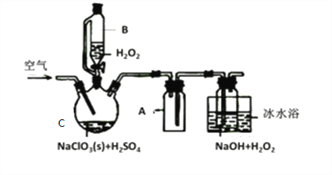
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),压缩体积,平衡正向移动,K值增大
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要 0.5mol·L-1 的 NaOH 溶液 480mL,现欲配制此溶液,有以下仪器:①烧杯② 100mL 量筒 ③100mL 容量瓶④胶头滴管⑤玻璃棒⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有__(填代号),还缺少的仪器是 。该实 验中两次用到玻璃棒,其作用分别是_________________,__________________ 。
(2)配制溶液时,一般可以分为以下几个步骤: ① 称量、②计算、 ③溶解、 ④倒转摇匀、⑤ 转移、⑥洗涤、⑦定容、⑧冷却,其正确的操作顺序为__(用序号填 空),其中在①操作中需称量 NaOH 的质量为______________g。
(3)下列操作结果会使溶液的物质的量浓度偏低的是_________。
A.没有将洗涤液转入容量瓶中
B.称量时用了生锈的砝码
C.定容时,俯视容量瓶的刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(4)若某学生用托盘天平称量药品时,在托盘天平左盘放有 20g 砝码,天平达平衡时游码的位置如图,则该同学所称量药品的实际质量为_________g。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀。已知高锰酸钾的还原产物是MnO2,则该反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com