
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
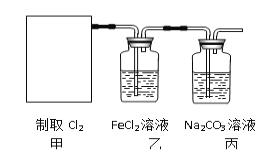
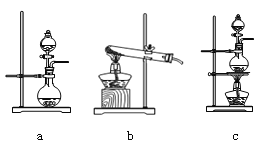
①在该实验中,甲部分的装置是_______(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,如何改进:______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4==H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈_______(填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为____________________________________。
(3)在:0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____(填字母)
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO42-)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO42-)___(填“<”“>”或“=”)0.029mol/L
(5)若25℃时,0.10mol/LH2SO4溶液的pH=-lg0.11,则0.10mol/LH2SO4溶液中c(SO42-)=____mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们分别位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是( )
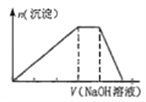
A. 简单氢化物的沸点:Y>X
B. 简单离子的半径:M>Y>Z
C. R与除Z以外的其他3种元素均能形成共价化合物
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。
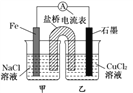
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:_____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是,“溶液中的十3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是_______________,电极反应为________________;乙装置中石墨(1)为_______(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为______________________。
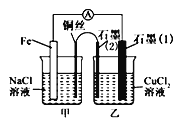
查看答案和解析>>
科目: 来源: 题型:
【题目】新制氯水的成分复杂,但饱和氯水久置后,成分发生变化,下列粒子①Cl2;②H2O;③Cl-;④HClO;⑤ H+,因饱和氯水久置而减少的是
A. ①②③ B. ①④ C. ②④ D. ①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是

A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
【答案】B
【解析】由图象可知N→M发生Al(OH)3+OH-===AlO2-+2H2O,设氢氧化钠溶液浓度为c,则消耗氢氧化钠0.01cmol,n[Al(OH)3]=n(AlCl3)=0.01cmol;ON消耗氢氧化钠0.05cmol,分别发生MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知n(MgCl2)=(0.05cmol-0.01c×3mol)/2=0.01cmol,则c(AlCl3):c(MgCl2)=1:1,M点时溶液成分为NaAlO2,之后继续加入溶液后沉淀质量逐渐增大,此时应加入盐酸,发生反应为:NaAlO2+HCl+H2O= Al(OH)3↓+NaCl,继续加入盐酸沉淀逐渐溶解,生成氯化镁、氯化铝和氯化钠,则消耗的氢氧化钠和HCl的物质的量相等,A.根据分析可知,N点时溶液中的溶质只有NaCl,A正确;B.原混合溶液中c(MgCl2):c(AlCl3)=1:1,B错误;C.由横坐标可知消耗盐酸和氢氧化钠的体积相同,则二者物质的量浓度相同,C正确;D.根据分析可知,M点之前加入的是NaOH溶液,M点之后加入的是盐酸,D正确;答案选B。
【题型】单选题
【结束】
16
【题目】证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是
①先滴加氯水,再滴加KSCN溶液后显红色
②先滴加KSCN溶液,不显红色,再滴加氯水后显红色
③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
④只需滴加KSCN溶液
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
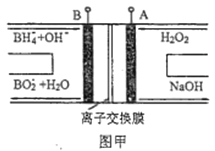
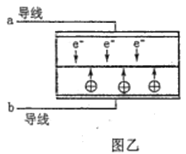
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com