
科目: 来源: 题型:
【题目】将 54.8g Na2CO3和 NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量某浓度的盐酸,收集到气体 V L.另一份直接加热至恒重,生成气体 2.24L(所有气体体积均在标准状况下测定).试准确计算出:
(1)原固体混合物中 Na2CO3的物质的量:nNa2CO3)=_____
(2)V=_____L.
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】用某废催化剂(主要成分Al2O3、K2O、少量CoO、SiO2等)来制取明矾的工艺流程如下图所示,回答下列问题:
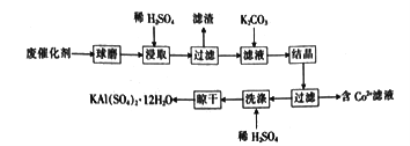
(1)废催化剂在浸取前进行球磨的主要目的是________________________________________。
(2)浸取时Al2O3溶解的化学方程式为________________________________________;
(3)滤渣的主要成分是_________________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2·12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/g | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)CO2的摩尔质量为_________,3.01×1023个CO2的质量为_________,在标准状况下其体积为_________;
(2)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸_________mL(保留两位有效数字);
(3)已知离子反应:RO3n﹣+6I﹣+6H+═R﹣+3I2+3H2O,推断:n=_________,R元素在RO3n﹣中的化合价是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
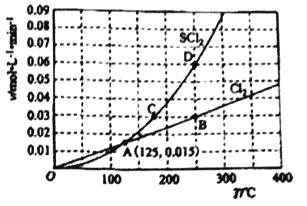
①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下图中序号①~③仪器的名称:

①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Ba2+、Fe3+、OH﹣、Cl﹣B.Mg2+、Na+、Cl﹣、SO42﹣
C.NH4+、Ba2+、NO3﹣、OH﹣D.H+、K+、NO3﹣、CO32﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】市场销售的某种精制食用盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O,______________
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式:_____________________________。
②某同学设计回收四氯化碳的操作步骤如下,请将缺少的操作步骤补充完整。
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3溶液
c.____________________ d.分离出下层液体。
(3)已知:I2+2S2O32=2I-+S4O62-。某质量检验监督局测定食用精制盐的碘含量,其步骤为:
a.准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,以6.0×10-4mol·L-1的Na2S2O3标准溶液滴定,消耗20.00mL标准液。
①判断c中滴定反应恰好完全的现象是_____________________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是____mg/kg。
(4)用惰性电极电解KI溶液可制备碘酸钾,则阳极反应式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com