
科目: 来源: 题型:
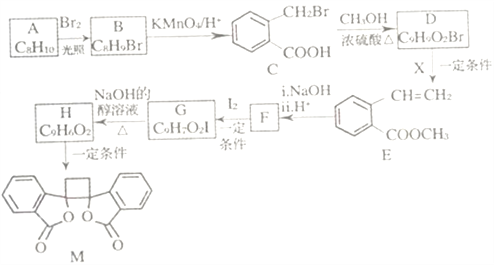
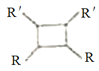
【题目】我国北方生长的一种植物中含有抗菌作用的化合物M,已知M的合成路线如下图所示:
已知:i.RCH2Br![]() R-HC=CH-R';
R-HC=CH-R';
ii.R-HC=CH-R'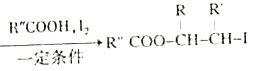 ;
;
iii.R-HC=CH-R'![]()
 (以上R、R'、R"代表氢、烃基等)。
(以上R、R'、R"代表氢、烃基等)。
(1)A的化学名称为_______,D中所含官能团的名称是______。由H生成M的反应类型为_____。
(2)运用先进的分析仪器,极大改善了有机物结构鉴定。
①可利用_______(填“质谱”“红外光谱”或”核磁共振氢谱)测得C的相对分子质量。
②测定B的结构:B的核磁共振氢谱显示为_____组峰。
(3)1molM与足量NaOH溶液反应,消耗_____molNaOH。
(4)X的结构式为_____,F的结构简式为______ 。
(5)由C生成H的化学方程式为__________。
(6)符合下列条件的B的同分异构体共______种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O![]() O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______。
(2)PO43-的空间构型是_______,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____(写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____b(填“>”、“=”或“<”),原因________。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___(填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______m3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:
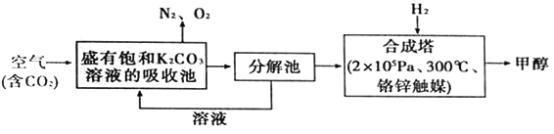
(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:
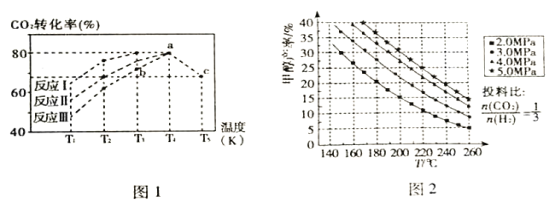
①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】向10mL 0.1mol·L1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表达式中正确的是( )
A. 向氯化钙溶液中通入CO2:CaCl2+CO2+H2O=CaCO3↓+2HCl
B. 铁跟盐酸反应:Fe+2HCl=FeCl2+H2↑
C. NaHCO3溶液的电离方程式:NaHCO3=Na++H+ +CO32-
D. 向沸水中滴加 FeCl3 溶液制备Fe(OH)3 胶体:FeCl3+3H2O=Fe(OH)3↓+3HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A. 1摩尔H2O质量为18g
B. 摩尔是国际科学界建议采用的一种物理量,简称摩,符号为 mol
C. 22.4LO 2 中所含氧气分子为1 摩尔
D. 1mol 氧含 6.02×10 23 个O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
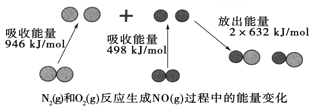
下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)是VIA族非金属元素,其单质和化合物在太阻能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____(填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)己知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______(α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一和工芝流程如下:
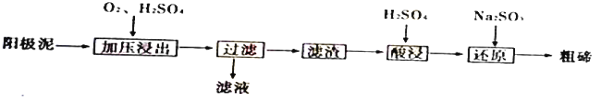
③己知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是_____________。
④防止局部酸度过大的操作方法是___________。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________。
⑥“还原”得到固态碲后分离出粗碲的方法是________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com