
科目: 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 。
(2)从B分子的立体结构判断,该分子属于 (填“极性”或“非极性”)分子。
(3)C分子中包含 个σ键, 个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质): 。
Ⅱ.CO的结构可表示为![]() ,N2的结构可表示为
,N2的结构可表示为![]() 。
。
(5)下表是两者的键能数据:(单位:kJ·mol-1)
A—B |
|
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因: 。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 ,基态Cu原子的外围电子排布式为 。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R 原子序数依次增大。由W、X、Y、R组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润的红色石蕊试纸变蓝的气体。金属单质Z在空气中燃烧生成的化合物可与水发生反应生成气体。下列说法正确的是
A. 简单离子的半径: X < Z < R
B. X的简单氢化物比Y的稳定
C. a、b、c中均含有极性共价健,且 a属于电解质,b和c都属于非电解质
D. W、X、Y、R四种元素形成的化合物一定会促进水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为有机物M、N、Q的转化关系,有关说法正确的是
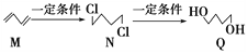
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是
A. 室温下,pH=12的Ba(OH)2溶液中Ba2+的数目为5×10-3NA
B. 14g乙烯和14g丙烯中含有的共用电子对数均是3NA
C. 1 mol FeI2与一定量氯气反应时,若有0.5mol Fe2+被氧化则转移的电子数为2.5NA
D. 0.4mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.1NA
2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com