
科目: 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。现在一容积为2L的密闭容器中充入2molSO2、1molO2,加入固体催化剂,保持温度在450℃使之发生反应,5min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A. SO2的转化率为30%
B. 反应共放出了196.6kJ的热量
C. 用SO2表示的5min内的平均反应速率为0.36mol·L-1·min-1
D. 平衡时SO3的浓度是0.9mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. 浓硫酸具有吸水性,可用于干燥O2
B. SO2具有氧化性,可用于漂白纸浆
C. Fe2O3能与酸反应,可用于制作红色涂料
D. Al(OH)3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式____________。
(2)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:___________。
(3)许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4等), CH3CH= CH 2 分子中3个C原子采取的杂化方式依次为___________。
(4)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀完全溶解。写出此蓝色沉淀溶解的离子方程式:_____________;
(5)B的氢化物比氨气的熔沸点略高,请解释原因:_____________;
(6)1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形。

请回答下列问题:
1)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)__________,并简述其理由:_______________。
2)C70和C60结构类似,则分子中含有______个六边形和______个五边形。
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00mL0.1000molL-1的氨水中逐滴加入0.1000molL-1的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的是( )

A. 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3H2O)
C. V(HCl)<20.00mL时,溶液一定呈碱性
D. V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验了探究这两种物质的性质。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,________。
(2)①取少量NaHCO3按下图装置进行实验。可观察到的现象是:大试管口有水珠生成,____________。

②用______________的方法除去混在Na2CO3粉末中少量的NaHCO3。
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为_________________。
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
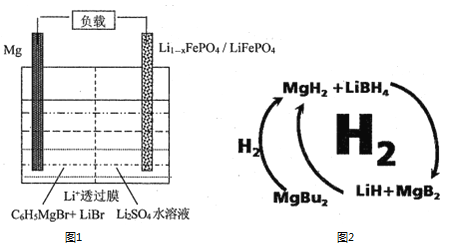
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
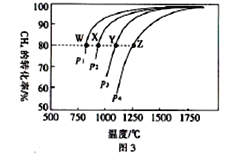
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是
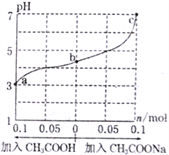
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
B. b点混合液中c(Na+)>c(CH3COO-)
C. 加入CH3COOH过程中, 增大
增大
D. 25℃时,CH3COOH的电离平衡常数Ka=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com