
科目: 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是
N2O4(g) △H=-57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是

A. 前10min内,用v(NO2)表示的化学反应速率为0.04mol·L-1·min-1
B. 反应进行到10min时,反应物的转化率约为33.3%
C. a点正反应速率小于逆反应速率
D. 25min时,改变的条件是增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验亚铁离子是否被氧化的方法:______________________________________________。
Ⅱ.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
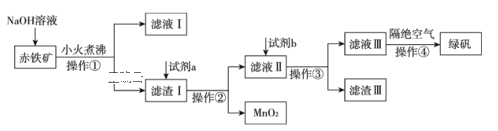
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
Ⅲ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________(填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。(碱石灰是氢氧化钠和氧化钙的混合物)

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是除去装置中的水蒸气和二氧化碳。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为____________________________、__________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________________________。
②E处干燥管中盛放的药品是________,其作用是________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为_________________________。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
(4)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式___________________________________________________。步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外还可能使产品中混有杂质____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学的说法正确的是
A | B | C | D |
|
|
|
|
钢闸门容易被腐蚀 | a、b均为惰性电极,a极电极反应为:H2-2e-=2H+ | 电池工作一段时间后,乙池溶液的总质量增加 | 阴、阳两极生成的气体的物质的量之比是1:1 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质镍的原理如图所示,已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+ >Ni2+(低浓度)。下列说法正确的是

A. 碳棒上发生的电极反应:2C1--2e-=Cl2 ↑
B. 电解过程中,B中NaCl 溶液的浓度将不断减小
C. 为了提高Ni的产率,电解过程中需要控制废水的pH
D. 若将图中阳离子交换膜去掉,则电解反应总方程式不发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,下列有关四个曲线图的说法正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②可以表示相同pH的醋酸和盐酸分别加水稀释时溶液的pH随溶液体积的变化
C. 图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时的pH变化
D. 由图④可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com