
科目: 来源: 题型:
【题目】已知某酸H2B在水溶液中存在下列关系:①![]() ②
②![]() ,关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
,关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A. NaHB属于弱电解质
B. 溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C. c(Na+)=c(HB-)+c(B2-)+c(H2B)
D. c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是常见的焙烤食品添加剂;NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ________(填“等于”“大于”或“小于”) 0.1mol/L NH4HSO4中c(NH4+)。
0.1mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线如图甲所示:

(2)图甲中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
(3)向100mL 0.1mol/L NH4Al(SO4)2溶液中滴入90ml 0.5mol/L NaOH溶液,产生白色沉淀__________克。
(4)写出NH4HSO4溶液中滴加足量NaOH溶液的化学方程式______________________________;
25℃时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。

(5)试分析图乙中a、b、c、d四个点,水的电离程度最大的是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI, ![]() H>0,H2的物质的量随时间的变化如图所示,下列说法正确的是
H>0,H2的物质的量随时间的变化如图所示,下列说法正确的是

A. 该温度下,恒容时充入HI气体,HI的百分含量增大
B. 0~2min内的HI的平均反应速率为0.05mol·L-1·min-1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
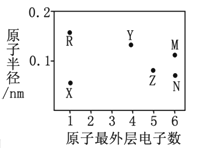
(1)M元素的原子核外有__________种能量不同的电子,有__________个未成对电子;Z元素在元素周期表中的位置是第______周期________族。
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是_____________;Y元素的氧化物是制造光纤的主要材料,该氧化物是________晶体(填晶体类型)。
某化工生产的核心环节的反应为:2MN2(g) + N2(g) 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式K=__________________________;欲使K值变大,可采取的措施是__________________________。
(4)该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡____________________。(选填“正向移动”、“逆向移动”或“不移动”)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应式:(1)2Fe3++2I﹣═2Fe2++I2;(2)Br2+2Fe2+═2Br﹣+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A. I﹣>Fe2+>Br﹣ B. Br﹣>Fe2+>I﹣
C. Br﹣>I﹣>Fe2+ D. Fe2+>I﹣>Br﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是

A. X极连接电源正极
B. X极上产生气体有刺激性气味
C. Y极上发生氧化反应
D. 电子从X极经过溶液流向Y极
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]() mol/L
mol/L
C. 加入醋酸钠固体,二者的pH均增大
D. 与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com