
科目: 来源: 题型:
【题目】下列实验方案合理的是( )
A. 配制银氨溶液:向洁净试管中加一定量AgNO3溶液后,边滴加稀氨水边摇动试管直至最初产生的沉淀恰好溶解。
B. 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液
C. 制备乙酸乙酯:用右图所示的实验装置
D. 鉴别甲苯和苯:将溴的四氯化碳溶液分别滴加到少量甲苯和苯中
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A. 研制水溶剂涂料替代有机溶剂涂料
B. 用可降解塑料生产包装盒或快餐盒
C. 用反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O制备硫酸铜
CuSO4+SO2↑+2H2O制备硫酸铜
D. 用反应:2CH2=CH2+O2![]()
![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制氨气常用以下两种方法:
①用固体氢氧化钙与氯化铵晶体反应制取;
②用固体生石灰与浓氨水混合制取。
请回答下列问题:
(1)写出方法①的化学方程式_______________。
(2)方法②能制取氨气的原理是___________________。
(3)检验氨气是否收集满的方法是______________________。
(4)通常用于证明氨气极易溶于水的实验是______________;氨水显碱性的原因是_____________。
(5)制备氨气的装置如下,方法①应选用_________(填字母,下同),方法②应选用__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】有机物L的分子式为C3H6O2,水解后得到饱和一元羧酸M和饱和一元醇N,已知M和N的相对分子质量相同,则下列叙述中不正确的是( )
A. M是甲酸 B. M中没有甲基
C. M中氢的质量分数为40% D. L是甲酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I一反应成I3一,并在溶液中建立如下平衡:I2+I一 ![]() I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3一。通过测平衡体系中c(12)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c (12),采用如下方法:取V1mL平衡混合溶液,用c mol/L的Na2S203溶液进行滴定(反应为I2+2Na2S203=2Nal+Na2S406),消耗V2mL的Na2S203溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用____ 做指示剂,滴定终点的现象是____。
(2)下列对该同学设计方案的分析,正确的是______填字母)。
A.方案可行。能准确测定溶液中的c (12)
B.不可行。因为I一能与Na2S203发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知:①I-和I3一不溶于CC14;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作I使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是____(填名称)。试指出该操作中应注意的事项为____。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________。
(5)实验测得上层溶液中c(I3一)=0.049 mol/L,结合上述有关数据,计算室温条件下反应I2+I一![]() I3一的平衡常数K= ___(用具体数据列出计算式即可)。
I3一的平衡常数K= ___(用具体数据列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
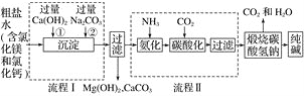
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiS04、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):
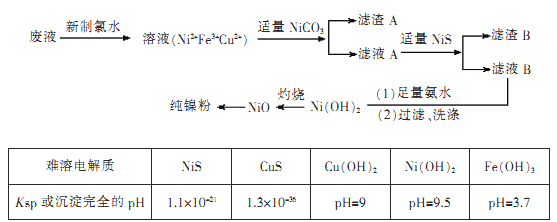
注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为____
(2)加入NiCO3的目的是________。
(3)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全角度评价两种方案的优点。
方案1.____
方案2.____
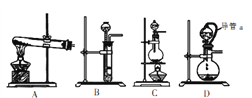
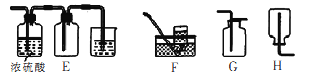
(4)方案2所用的氢气可以选用下列装置中的____来制取(填写字母,下同),收集氢气可选用装置________。
(5)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的____。装置D中导管a的作用是____。
a.CO2 b.Cl2 c.NO d.SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素是造成水体富营养化的主要原因,在水中常以氨氮或NO3形式存在。
(1)在pH为4~6时,用H2在Pd-Cu催化下将NO3-还原为N2可消除水中NO3。该反应的离子方程式为____。若用H2和CO2的混合气体代替H2,NO3-去除效果更好,其原因是____。
(2)NaClO氧化可除去氨氮,反应机理如图1所示(其中H2O和NaCl略去),实验测得相同条件下,相同反应时间,pH与氨氮的去除率关系如图2所示,温度与氨氮去除率关系如图3所示。



图1 图2 图3
①NaClO氧化NH3的总反应的化学方程式为____。
②如图2所示,在pH>9时,pH越大去除率越小,其原因是____。
③如图3所示,温度低于15℃时,温度越低去除率越低其原因是____。当温度高于25℃时,温度越高去除率也越低,其原因是____。
(3)用电化学法可去除废水中的氨氮。在含NH4+的废水中加入氯化钠,用惰性电极电解。反应装置如图4所示,则电解时,a极的电极反应式为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com