
科目: 来源: 题型:
【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
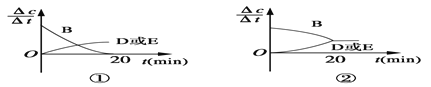

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
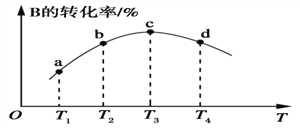
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目: 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
![]()
(4)滴定。当___________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
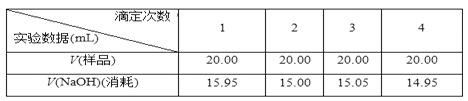
Ⅲ.实验处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。 指出他的计算的不合理之处:_____;按正确数据处理,可得市售白醋总酸量=______ g/100 mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗 b.碱式滴定管尖嘴滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加少量水 d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是
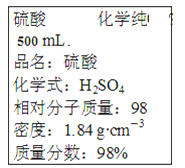
A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目: 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目: 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
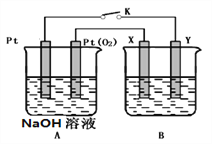
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:
S+3C+2KNO3![]() N2↑+3CO2↑+K2S
N2↑+3CO2↑+K2S
请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为_____,还原剂的物质的量为_____mol。
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是_____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com