
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。

(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室配制 500mL 0.2mol/L 的 NaOH溶液,在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外, 配制上述溶液还需要的玻璃仪器是_________。
具体过程如下:
①计算需要称量 NaOH 固体的质量_____;
②用少量蒸馏水洗涤烧杯内壁 2~3 次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
③用托盘天平称量 NaOH 固体;
④将 NaOH 溶液沿玻璃棒注入_____中;
⑤将称好的 NaOH 固体放入烧杯中,用适量蒸馏水溶解,并____________;
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将蒸馏水注入容量瓶,液面离刻度线下_____cm 时,改用_______滴加蒸馏水至液面于刻度线相切;
试回答下列问题:
(2)上述过程的正确顺序为___________(填步骤序号);
(3)经精确测量,最后所得溶液物质的量浓度为 0.192mol/L,原因可能是____________。
A、使用滤纸称量 NaOH 固体; B、未冷却直接转移至容量瓶,立即配好;
C、容量瓶中原来有少量蒸馏水; D、称量时所用的砝码生锈;
E、溶解 NaOH 后的烧杯未经多次洗涤; F、定容时俯视刻度。
查看答案和解析>>
科目: 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(2)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A. c(H+)= c(CH3COO-)+ c(OH-)
B. 加入少量CH3COONa固体后,c(CH3COO-)降低
C. 该溶液中由水电离出的c(H+)是1.0×10-11mol/L
D. 与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨的催化氧化法制备硝酸。
(1) 已知反应N2(g)+3H2(g) 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是(_______)
A.容器内N2、H2、NH3的浓度之比为1:2:3
B. v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)理论上,为了增大平衡时的转化率,可采取的措施是_____________(要求答出两点)
⑶合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率_____ 逆反应速率(填“大于”、“小于”或“等于”)
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
(4)消除硝酸工厂尾气的一种方法是用甲烷催化还原氮氧化物,已知:
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为___________________________________________
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式),当两种沉淀共存时,溶液中C(Mg2+)/C(Cu2+)=_________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目: 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
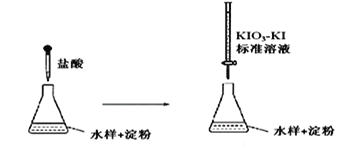
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
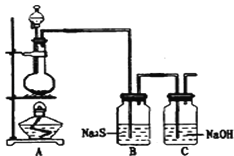
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为_____,物质的量之比为_____,质量之比为_____。
(2)等质量的 SO2 和 SO3 物质的量之比是_____,氧原子数之比为_____。
(3)19 g 某二价金属的氯化物 ACl2 中含有 0.4mol Cl-,则 A 的摩尔质量为_____。
(4)密度为 1.84 g/cm3,质量分数为 98%的浓硫酸浓度为_____mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
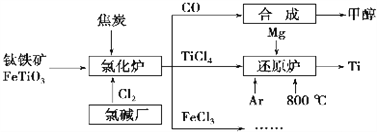
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________(用TiO2·xH2O或H2TiO表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____(填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验结果与图像不相符的是

A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com