
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
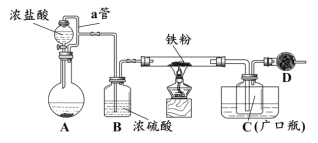
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______ 、 ___。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_______(填操作序号)。
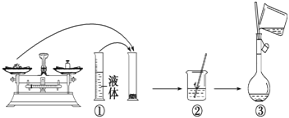
(3)称取NaOH固体时,所需砝码的质量为___________(填写字母)
A.19.2g B.20g C.19.2g ~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)_____________
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是_________
A.NaOH固体长期暴露在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量碳酸钠固体时,若将物质和砝码放反
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
E.定容时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、CO32-、SO42-、NO3-中的若干种离子,离子浓度均为0.1mol/L,某同学进行如下实验。下列说法正确的是

A. 无法确定沉淀C 的成分
B. 无法确定原试液中是否存在K+、Al3+、Cl-、
C. 试液中可能含有CO32-、K+、NH4+
D. 试液中一定存在的离子为NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:常温下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加几滴稀硝酸银溶液,出现白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,发生反应:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
(2)取物质的量浓度均为 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略体积改变)。当 AgNO2开始沉淀时,计算溶液中Cl-的物质的量浓度(写出必要的计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
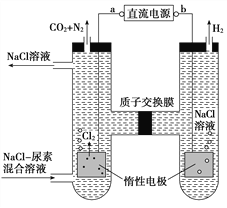
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目: 来源: 题型:
【题目】现代传感技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验 (装置如图1所示),并用中和滴定实验测定所得氨水的浓度。
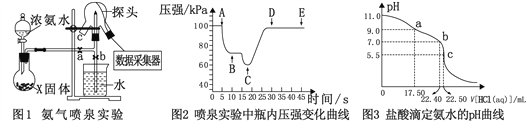
Ⅰ. 用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中X固体可以是_______________。
(2)关闭a,将吸有2 mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。则AB段压强变化的原因是__________。
Ⅱ. 室温下,用盐酸滴定得到的氨水,测定氨水的浓度。
(3)从三颈瓶中用______________(填仪器名称)量取25.00 mL氨水至锥形瓶中,用0.050 mol·L-1 盐酸滴定。用pH计采集数据、电脑绘制滴定曲线(图3)。则:
①该滴定的终点为_____________(填“a”、“b”或“c”);
②b点对应的溶液中,c(NH4+) _______ c(Cl-) (填“>”、“<”或“=”);
③据图,计算氨水的浓度为___________。
(4)该滴定实验中,若酸式滴定管未用盐酸润洗会导致测得氨水的浓度____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
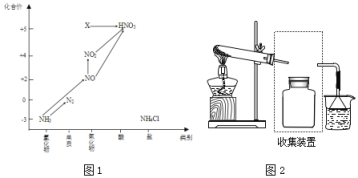
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
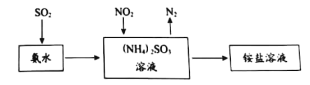
NO2被吸收过程的离子方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At)是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:

A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com