
科目: 来源: 题型:
【题目】电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜 隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变 浅。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列说法不正确的是( )
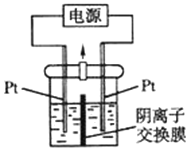
A. 右侧发生的电极反应式:2H2O+2e﹣=H2↑+2OH﹣
B. 电解结束后,右侧溶液中含有 IO3﹣
C. 电解槽内发生反应的总化学方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
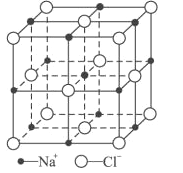
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气遇氯气时,有白烟出现,发生的反应可能有①2NH3+3Cl2=6HCl+N2 ②NH3+HCl= NH4Cl下列说法正确的是()
A. ①为化合反应 B. ②为置换反应 C. ①氧化还原反应 D. ②为复分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
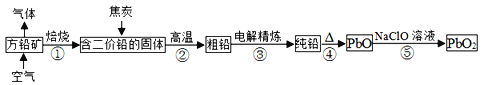
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
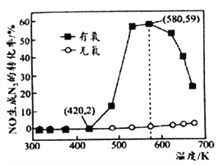
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
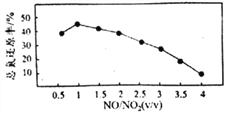
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中以Zn、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬晶体,其装置如下图所示。仪器2中已预先加入锌粒,仪器3中已加人CH3COONa溶液。

资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]22H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O
④Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4,lg2≈0.3
≈4,lg2≈0.3
回答下列问题:
(1)仪器1的名称是_______________。
(2)实验时先往仪器2中加盐酸,一段时间后再加CrCl3溶液,目的是_________。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_______,打开阀门_______。
(4)本实验中锌粒要过量,其原因除了使产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_______________。
(5)铬的离子会污染水资源。常温下要除去上述实验中多余的Cr2+,①先向废液中通入足量的______,将Cr2+转变为Cr3+,反应的离子方程式为_______;②再加入碱液,调节pH至少为_____才能使Cr3+沉淀完全[c(Cr3+)<10-5mol/L]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com