
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )

A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度均为0.1 molL-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是

A. HX的酸性弱于HY的
B. a点由水电离出的c(H+)=1×10-12 molL-1
C. c点溶液中:c(Y-)>c(HY)
D. b点时酸碱恰好完全中和
查看答案和解析>>
科目: 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO3)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________、 ______________________________
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为___________________________
③Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。

①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________。增加压强,NO的转化率_______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“提高”、“不变”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,取0.lmolL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因_____(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)___0.1 molL-1NaOH 溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:____。
(4)混合液中: c(HA)+ c(A-)=_______ molL-1。c(Na+)-c(A-)=_______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4A C.NH4HSO4 D.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )

A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CO为原料生产二甲醚的反应为:3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
实验 序号 | 容器 体积 | 起始物质的量 | 达平衡时 放出热量 | |
H2 | CO | |||
Ⅰ | 2L | 8mol | 8mol | 494 kJ |
Ⅱ | 2L | 4mol | 4mol | —— |

(1)上述反应平衡常数K的表达式为_____。
(2)由题意可知,a=______,b________1(填“>”、“<”或“=”)。
(3)实验Ⅰ中,反应前10 min内的平均速率v(H2)=_____。
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是______ (填写序号字母)。
a.及时分离出CH3OCH3气体b.保持容器的容积不变,再充入1 mol CO和1 mol H2
c.适当升高温度 d.保持容器的容积不变,充入1 mol 氦气
(5)T℃时,若容器中含1 molL-1 H2、2 molL-1 CO、2 molL-1 CH3OCH3、3 molL-1 CO2,则此时v正________v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.焰色反应是化学变化
B.CO2通入CaCl2溶液中会产生白色沉淀
C.Fe3+遇KSCN溶液会产生红色沉淀
D.25 ℃,Na2CO3在水中的溶解度比NaHCO3大
查看答案和解析>>
科目: 来源: 题型:
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是
A. Na、K、Cl B. Mn、Fe、B
C. N、Mg、Mo D. Mo、Ca、Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】在NaCl和NaBr的混合溶液中,Na+、Br-、Cl-的物质的量浓度之比不可能出现的是 ( )
A. 3:2:2 B. 5:3:2 C. 5:4:1 D. 3:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
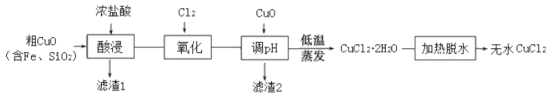
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com