
科目: 来源: 题型:
【题目】向50 mL 14.0 molL﹣1浓硝酸中加入足量铜,充分反应后共收集到标准状况下4.48 L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应铜的质量为
A. 6.4gB. 12.8gC. 16.0gD. 19.2g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于核酸的叙述中不正确的是 ( )
A. 核酸是遗传信息的载体
B. 核酸的基本组成单位是脱氧核苷酸
C. 不同生物所具有的DNA和RNA有差异
D. 细胞的DNA主要分布在细胞核中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,都是强电解质的是( )
A.HNO3、HCl、BaSO4B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2OD.HClO、CH3COONa、Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入足量稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
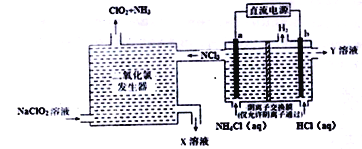
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇肉桂酸酯G可用于光刻工艺中作抗腐蚀涂层。下面是一种合成该有机物的路线(部分反应条件及产物已省略):
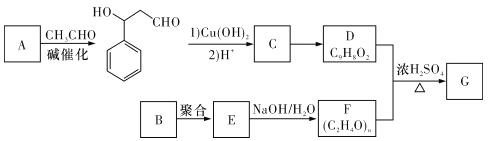
已知以下信息:
I.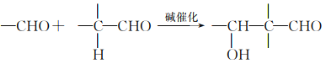 ;
;
Ⅱ.D能使酸性KMnO4溶液褪色;
Ⅲ.同温同压下,实验测定B气体的密度与气态己烷的密度相同,B中含有一个酯基和一个甲基。
请回答下列问题:
(I)A的化学名称是_________。
(2)由C生成D的过程中可能生成多种副产物,其中与D互为同分异构体的有机物的结构简式为______。
(3)B的分子式为__________。
(4)由D和F生成G的化学方程式为_____________。
(5)满足下列条件的C的同分异构体有________种(不考虑立体异构)。
①该有机物是一种二元弱酸,并能使FeC13溶液显色;
②苯环上有三个取代基,并能发生银镜反应。
(6)由D经如下步骤可合成K:
![]()
①H中官能团的名称为 _______________。
②I的结构简式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.O、S、Na的原子半径依次减小
B.LiOH、KOH、CsOH的碱性依次减弱
C.NH3、PH3、SiH4的热稳定性依次减弱
D.HCl、HBr、HI的还原性依次减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2 (g)![]() C6H6 (g) H1
C6H6 (g) H1
合成乙苯:C6H6(g)+C2H4(g)![]() C6H5CH2CH3(g) H2
C6H5CH2CH3(g) H2
乙苯脱氢:C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10mol C6H5CH2CH3 (g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K= ______(结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____(填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的H3______0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)
查看答案和解析>>
科目: 来源: 题型:
【题目】熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是_____________(填序号)。
(2)蒸发皿的使用:把滤液倒入蒸发皿中,再把蒸发皿放到铁架台的铁圈上。用酒精灯加热,同时用玻璃棒不断搅拌,以防止___________。当蒸发皿里的液体较少时,则应____________________,利用余热,使剩余溶剂挥发。
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂(固体试剂任选)有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:

①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为____,制取该气体利用了B的性质有____、___________。
②通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为____;若在乙中收集氨气,气体流经装置的顺序是a→___→___→d(填接口代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com