
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.钠在空气中燃烧最后所得产物为过氧化钠
B.镁在空气中能稳定存在,是因为其表面形成了致密的氧化膜
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁不能形成致密的氧化膜,在潮湿的空气中易生锈
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒液流电池足一种新型的绿色环保储能电池。其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+,下列说法正确的是
VO2++2H++V2+,下列说法正确的是
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.充电时阴极反应为:V2+-e-=V3+
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】煤矸石(主要成份是SiO2和Al2O3还含有少量的Fe2O3、K2O、TiO2)活化后,可以制备六水三氯化铝(AlCl3·6H2O),工艺流程如下图所示。
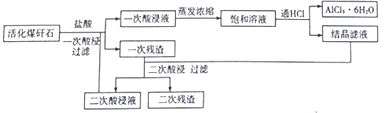
回答下列问题:
(1)焙烧至700℃左右可使煤矸石活化,活化过程中会发生一系列反应,写出SiO2与K2O反应的化学方程式______________,焙烧后的矸石颗粒有微孔,不需研磨成粉即可进行酸溶,原因是_____________。
(2)本工艺的突出特点是通过向饱和溶液中通HCl来得到产品和对一次残渣进行二次酸浸,HCl的作用是_________________和抑制Al3+水解,二次酸浸的目的是___________________。
(3)四轮循环后所得结晶滤液中,含有较多杂质离子,必须在常温下进行如下图所示的处理
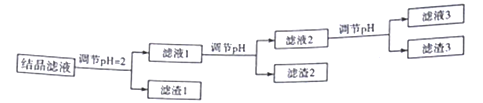
已知:Ksp(Fe(OH)3]=1.0×10-38,Ksp(Al(OH)3]=1.0×10-33,当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全。
滤渣1中所含金属元素为___________,获得滤渣2时,应调节溶液的pH至少为_________,在该流程中,滤渣3可循环使用,则生成滤渣2的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,下列说法正确的是( )
2PbSO4+2H2O,下列说法正确的是( )
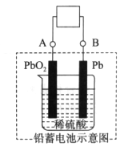
A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO42﹣=PbSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于浓硫酸的叙述正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖碳化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:
 已知:RCHO+CH3CHO
已知:RCHO+CH3CHO![]() RCH(OH)CH2CHO。
RCH(OH)CH2CHO。
试回答:
(1)A的化学名称是_________,A→B的反应类型是_________。
(2)B→C反应的化学方程式为_____________________________。
(3)C→D所用试剂和反应条件分别是_____________。
(4)E的结构简式是______________。F中官能团的名称是________________。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有______种。其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2∶1∶2∶2∶1的同分异构体的结构简式为______________。
(6)写出用乙醇为原料制备2-丁烯醛的合成路线(其他试剂任选):_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学–选修3:物质结构与性质)碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_____________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:________________。

(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Gr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式__________;CH3COOH分子中碳原子的杂化类型为___________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③铜铬合金的晶胞如图所示,已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的在导线中电流的方向为由______(用a、b表示)。
(2)负极反应式为______,正极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO3a-。回答下列问题:
(1)阳极泥预处理时发生反应:Cu2Te+O2![]() CuO+TeO2,Cu2Te中Te的化合价为________,该反应中氧化剂与还原剂的物质的量之比为__________。
CuO+TeO2,Cu2Te中Te的化合价为________,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)“过滤Ⅰ”所得滤液中,阴离子主要有___________,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是__________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为___________________,防止酸度局部过大的操作是____________________。
(4)步骤④发生反应的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com