
科目: 来源: 题型:
【题目】Ⅰ.某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为________________;仪器b中的试剂不能为下列中的____________(填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.熟石灰
(2)装置B的作用是_______________
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式_______________
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含m、n字母的代数式表示)
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式______________________________。
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为___________(写化学式),向氯化亚铁溶液中加入烧碱溶液,现象为_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某物质的结构简式如图所示,下列有关该物质的说法不正确的是( )

A. 该物质的分子式为C13H16N2O5
B. 该物质是由两分子不同的氨基酸经脱水缩合而得
C. 该物质属于蛋白质
D. 1 mol该物质最多可与2 mol NaHCO3溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=_________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)=___________,T1℃时,该反应的平衡常数K=_______
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.通入一定量的NO b.通入一定量的N2
c.适当升高反应体系的温度 d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_________(填选项编号)。
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=_______ mol/L。NO的转化率_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目: 来源: 题型:
【题目】今年是“化学元素周期表国际年”,有关118号元素295Og说法错误的是( )
A.原子核外电子数为118B.是零族元素
C.位于第六周期D.原子的质量数为295
查看答案和解析>>
科目: 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH、HCO3、Cl七种离子中的两种可以形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
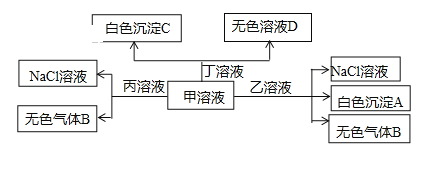
A. 白色沉淀A可能能溶解在溶液D中
B. 在甲中滴加丁可能发生反应:HCO3 + Ba2+ + OH == BaCO3 ↓ + H2O
C. 溶液丙与I、NO3、SO42 可以大量共存
D. 溶液乙一定是AlCl3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。则下列说法中正确的是 ( )
⑴ 0.25 mol Na2O2中含有的阴离子数为0.5NA
⑵ 7.5 g SiO2晶体中含有的硅氧键数为0.5 NA
⑶ 标准状况下,2.24 L CCl4中含有的原子数为0.1 NA
⑷ 常温下,1 L 0.1 mol/L FeCl3溶液中含Fe3+数为0.1NA
⑸ 1 L 1 mol/LCH3COOH溶液中含有NA个氢离子
⑹ 常温下,2.7 g铝与足量的氢氧化钠溶液反应,失去的电子数为0.3NA
⑺ 22.4 L SO2气体,所含氧原子数为2NA
⑻ 14 g乙烯和丙烯的混合物中,含有共用电子对数目为3 NA
⑼ 25℃时,pH =13 的1.0 LBa(OH) 2 溶液中含有的OHˉ数为0.2NA
A. ⑵⑸⑻⑼ B. ⑵⑹⑻ C. ⑴⑷⑹⑻⑼ D. ⑴⑶⑸
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) ![]() H2O(l) △H=-300KJ·mol-1
H2O(l) △H=-300KJ·mol-1
C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( )
A. 7:10B. 3:1C. 10:7D. 1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】常用的油脂、蜡的漂白剂、化妆品助剂、橡胶硫化剂:C14H10O4。下面是以物质A为原料合成C14H10O4的流程:

提示:①2010年赫克、根岸英一和铃木章因在“钯催化交叉偶联反应”研究领域作出了杰出贡献,而获得了诺贝尔化学奖,其反应机理可简单表示为:![]()
②苯乙烯和甲苯与酸性KMnO4溶液反应产物相同。
请回答下列问题:
(1)物质A的分子式为____________,物质C中含有的官能团的名称为________,D的结构简式为_____________;
(2)反应①—④中属于取代反应的有__________________;
(3)反应①的化学反应方程式___________;反应②的化学反应方程式______;
(4)某物质E为漂白剂(C14H10O4)的同分异构体,同时符合下列条件的E的同分异构体有_________种;
①含有联苯结构单元(![]() ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
②遇FeCl3溶液不显紫色,且苯环上核磁共振氢谱有六个吸收峰。
(5)请写出以苯乙烯和乙烯为原料,合成 的流程,无机物任选,注明反应条件_____。示例如下:
的流程,无机物任选,注明反应条件_____。示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com