
科目: 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置模拟生成过程。
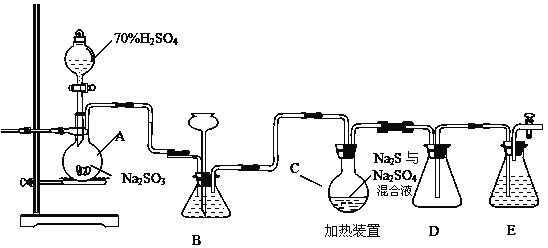
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 __________________________,则整个装置气密性良好。装置D的作用是___________________________。装置E中为___________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为______________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________ 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是_______________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有___________________。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】与Al反应放出大量氢气的溶液中,下列离子可能大量共存的是
A.Mg2+、Na+、Cl-、NO3-B.K+、Na+、Cl-、HCO3-
C.Na+、NH4+、Cl-、CH3COO-D.Fe2+、Ba2+、Cl-、I-
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图。下列说法不正确的是

A. 酸溶时,常需将烧渣粉碎、并加入过量H2SO4,其目的是提高铁元素的浸出率,同时抑制铁离子的水解
B. 反应②的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2S042-+16H+
C. 加入NH4HCO3生成FeCO3,检验FeCO3是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴如盐酸酸化的氯化钡溶液,若无沉淀生成说明洗涤干净
D. 锻烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向100mL 0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
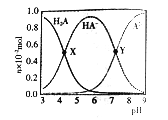
A. H2A在水中的电离方程式是:H2A=H++HA-, HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. Y点溶液中存在以下关系: c(H+)+c(Na+)=c(OH-)+3c(HA-)
D. X点溶液中含A元素相关微粒:c(H2A)+c(HA-)+c(A2-)=0.1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】80g CuSO45H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
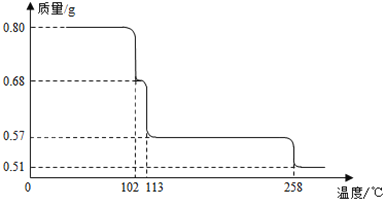
请回答下列问题:
(1)试确定 200℃时固体物质的化学式_________;
(2)取 270℃所得样品,于 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1-36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
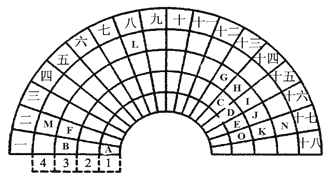
(1) D代表的元素处于常见元素周期表的位置是第 _____ 周期________ 族。
(2)元素F、G、I、K、M的原子半径由大到小的顺序是___________________(用元素符号表示)。
(3)B、F、G三种元素三种元素最高价氧化物对应水化物碱性最强的碱是_________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
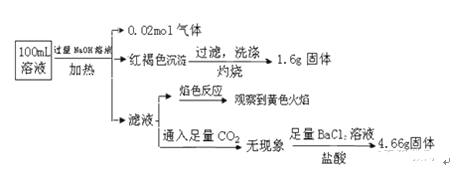
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | V A | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,在这些元素中,化学性质最不活泼的是:________________(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_________,碱性最强的化合物是/span>_________。
(3) 最高价氧化物是两性氧化物的元素是_________。
(4) 元素④与⑥形成的化合物属于___________________ (填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式 __________________。
(6)写出⑥的原子结构示意图_____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
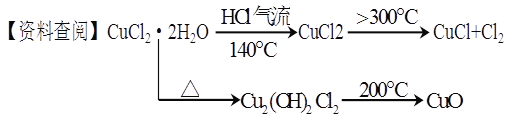
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
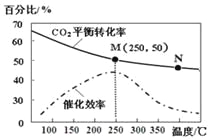
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com