
科目: 来源: 题型:
【题目】Ca、Sr、Ba是第IIA族相邻的三种元素,下列关于Sr的推测正确的是
A.Sr是一种金属元素B.Sr是一种良好的半导体材料
C.Sr的硫酸盐易溶于水D.Sr的最高价氧化物对应水化物是一种强碱
查看答案和解析>>
科目: 来源: 题型:
【题目】对于温度与反应方向的关系,下列判断不正确的是( )
A.ΔH<0,ΔS>0,所有温度下反应自发进行
B.ΔH>0,ΔS>0,所有温度下反应自发进行
C.ΔH<0,ΔS<0,低温下反应自发进行
D.ΔH>0,ΔS<0,所有温度下反应不能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题。
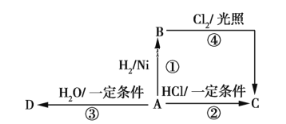
(1)写出A、B、C、D的结构简式:A_____, B_____,C_____, D______。
(2)写出②、④两步反应的化学方程式,并注明反应型:
②___________,反应类型________;
④___________,反应类型________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
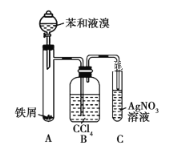
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目: 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
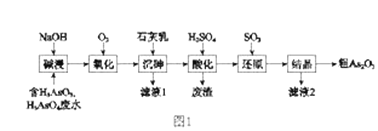
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
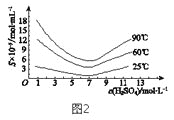
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com