
科目: 来源: 题型:
【题目】工业上通常采取CO(g)和H2(g)合成CH3OH(g)
(1)已知某温度和压强下
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
则在相同温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式__________。若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
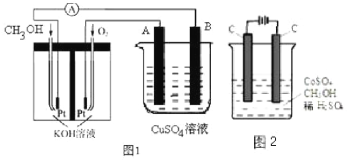
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是 ( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:RCH2COOH![]() RCHClCOOH、
RCHClCOOH、![]() 。
。
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
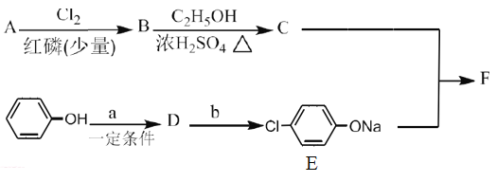
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出B→C的反应方程式:__________。
(4)C+E→F的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
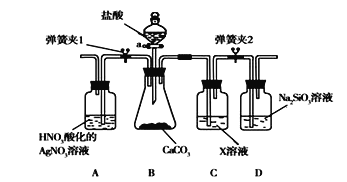
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2当…时,关闭活塞a。
请回答:
(1)盛放盐酸的仪器名称是___________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.酸性 B.还原性 C.氧化性 D.挥发性
(3)C装置中的X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的现象是___________________。
若通入D中的CO2足量,D中发生反应的离子方程式是______________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目: 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
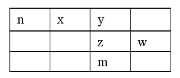
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是:( )
A.加入硫酸铜溶液加快实验室制氢气的速率
B.硫酸铝溶液不能放在铁质容器中
C.用热的纯碱溶液去除油污
D.浓硫化钠溶液有硫化氢的气味
查看答案和解析>>
科目: 来源: 题型:
【题目】道路千万条,安全第一条,行车不规范,亲人两行泪。减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气嚢内一般充入的是叠氮化钠(NaN3)、硝酸铵(NH4NO3)、硝酸钾(KNO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解或发生反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
请回答下列问题:
(1)下列判断正确的是_______。
A.道路起雾与H2O分子的化学键断裂有关
B.NH4NO3、KNO3中含有化学键的类型完全相同
C.NaN3不会和酸性高锰酸钾或次氯酸钠溶液反应
D.NaN3、NH4NO3固体在储存和使用时都必须格外小心,以免发生爆炸
(2)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
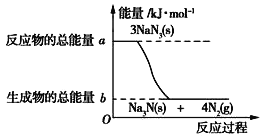
①叠氮化钠的爆炸反应属于_______(填“吸热”或“放热”)反应。
②若爆炸过程中有30mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为____kJ(用含a、b的代数式表示),消耗叠氮化钠的质量为_________g。
(3)若安全气囊内充的是叠氮酸钠和硝酸钾,撞击时发生的反应是10NaN3+2KNO3=K2O+5Na2O+16N2↑。当该反应的氧化产物比还原产物多1.4mol,则转移电子的物质的量是________mol,同时气囊内还必须充入一定量的SiO2粉末,其在安全气囊内所起的作用可能是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com