
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol·L-1的K2SO4溶液中含有2 mol K+
B. 1 mol Cl2完全溶于水转移电子数为NA
C. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为4NA
D. 20 g T2O中含有NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 葡萄糖的燃烧热是2800 kJ/mol,则![]()
B. 已知2C(s)+O2(g)===2CO(g)ΔH=-221 kJ/mol,则该反应的反应热为221 kJ·mol-1
C. 已知稀溶液中,H+ (aq)+OH- (aq)===H2O(l)ΔH=-57.3 kJ·mol-1 ,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将体积都为10mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积为 ( )
A.a>bB.a<bC.a<b<100mLD.a=b=100mL
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
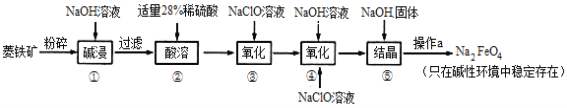
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
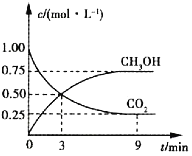
(1)3~9min内,v(H2)=_______mol·L-1·min-1。
(2)平衡时CO2的转化率为______。
(3)平衡时混合气体中CH3OH(g)的体积分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
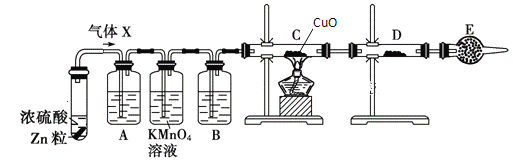
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为_______
(2)A中加入的试剂可能是_____,作用是_____;B中加入的试剂可能是_____,作用是_____;E中加入的试剂可能是_____,作用是_____
(3)可以证明气体X中含有氢气的实验现象:C中______,D中____。
查看答案和解析>>
科目: 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
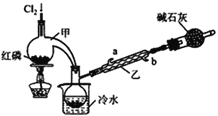
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
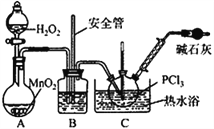
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)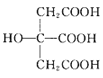 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
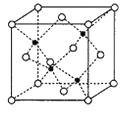
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是_______________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)==CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式_________________________________。
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2 和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0. 58 | 0. 40 | 0. 40 | 0. 48 | 0. 48 |
N2 | 0 | 0. 21 | 0.30 | 0. 30 | 0. 36 | 0. 36 |
①0~10min内,NO的平均反应速率v(NO)=_____,当升高反应温度,该反应的平衡常数K____________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_________(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C 和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图
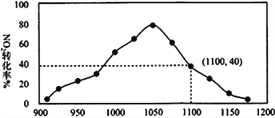
请从动力学角度分析,1050 kPa 前,反应b 中NO2转化率随着压强增大而增大的原因____________;在1100 kPa时,NO2的体积分数为_________________________。
(5)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(p分)=气体总压(p总)× 体积分数。
查看答案和解析>>
科目: 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com