
科目: 来源: 题型:
【题目】X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A. 原子半径由小到大的顺序:X< Y < Z< W
B. Z的最高价氧化物能与水反应生成相应的酸
C. Y单质在一定条件下可以与氧化铁发生置换反应
D. X、Z的氧化物形成的晶体类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了如下图装置,反应完毕,电解质溶液的pH保持不变。下列说法正确的是
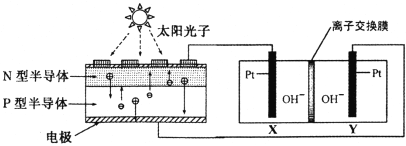
A. 图中N型半导体为正极,P型半导体为负极
B. Y 电极的反应:4OH--4e-=2H2O +O2↑
C. 图中离子交换膜为阳离子交换膜
D. 该装置实现了“太阳能→化学能→电能”的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应太慢。为了加快该反应的化学反应速率且不改变H2的产量,可以使用如下方法中的( )
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加NaOH固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10 mL 0.1 mol·L-1盐酸
A. ①⑥⑦ B. ②③⑥⑦ C. ③⑥⑦ D. ④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】1923年,在汉阳兵工厂工作的我国化学家吴蕴初先生研制出了廉价生产味精的方案,并于1926年向英、美、法等化学工业发达国家申请专利。这也是历史上,中国的化学产品第一次在国外申请专利。以下是利用化学方法合成味精的路线:
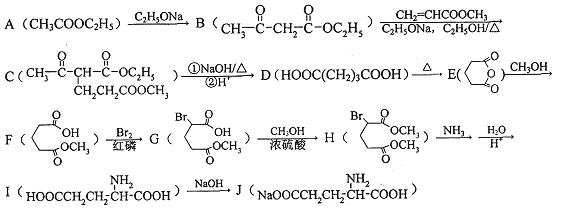
请回答下列问题:
(1)下列有关氨基酸的说法正确的是_______(填字母标号)。
A.氨基酸是组成蛋白质的基本结构单位 B.氨基酸都是α—氨基酸
C.氨基酸都有两性 D.氨基酸都难溶于水
(2)化合物I的化学名称为___________。
(3)F中官能团的名称为__________;由B生成C的反应类型___________。
(4)写出由A生成B的化学方程式___________。
(5)符合下列要求的B的同分异构体共有20种。写出任意两种的结构简式为____________。
①结构中含有六元环
②能在NaOH溶液中发生水解反应
③lmol该物质与足量金属Na反应能够生成0.5molH2
(6)参照上述合成路线,写出以丙酸(CH3CH2COOH)和甲醇为原料(其他无机试剂任选),合成丙氨酸(![]() )的线路。_____________
)的线路。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下:
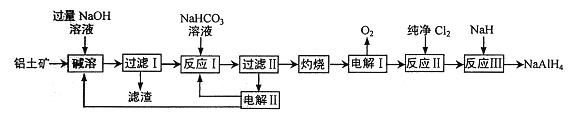
注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。
(1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。
(2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。
(3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
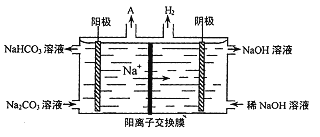
阳极的电极反应式为_________________。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
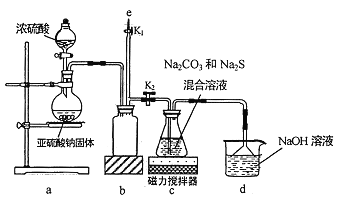
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。

③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P原子的投影),用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)。______
查看答案和解析>>
科目: 来源: 题型:
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
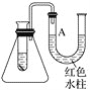
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:

(1)过程I :2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=+313.2 kJ/mol
6FeO(s)+O2(g) △H=+313.2 kJ/mol
①过程I需要将O2不断分离出去,目的是______________。
②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是____(填字母标号) 。
a.容器内气体密度和相对分子质量都不再改变
b.升高温度,容器内气体密度变大
c.向容器中通入N2,Fe3O4 转化率不变
d.缩小容器容积,O2(g)浓度变大
③在压强p1下,Fe3O4的平衡转化率随温度变化的曲线如图甲所示。若将压强由p1增大到p2在图甲中画出p2的α(Fe3O4)~T 曲线示意图。___________
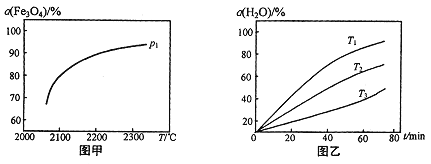
(2)已知H2的燃烧热是285.8kJ/mol,则液态水通过过程II转化的热化学方程式为______。
(3)其他条件不变时,过程II在不同温度下,H2O的转化率随时间的变化α(H2O)~t曲线如图乙所示,温度T1、T2、T3由大到小的关系是_________,判断依据是_________。
(4)科研人员研制出透氧膜(OTM),它允许电子和O2-同时透过,可实现水连续分解制H2,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示:
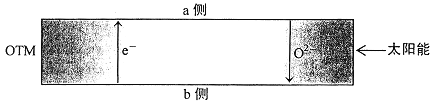
CO 在________侧反应(填“a”或“b”),另一侧的电极反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是恒温下H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
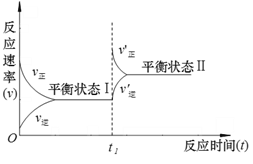
A. 升高温度
B. 增大压强
C. 增大反应物浓度
D. 加入催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com