
科目: 来源: 题型:
【题目】下列有关苯、乙酸、乙醇说法正确的是
A. 都不易溶于水
B. 除乙酸外,其余都不能与金属钠反应
C. 苯能与溴水在铁作催化剂下发生取代反应
D. 乙醇与乙酸都能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是
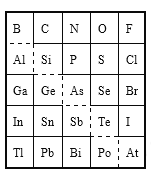
A. Sn的最高正价为+4
B. Br的最高价氧化物对应水化物的化学式为HBrO3
C. 酸性强弱:H3AsO4<H2SeO4
D. 原子半径比较:N<Si
查看答案和解析>>
科目: 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是
A.NO3-、Cl-B.CO32-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
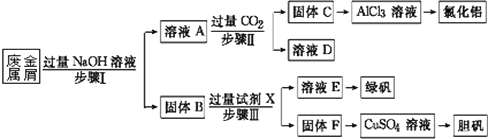
请回答:
(1)写出步骤Ⅰ中Al与NaOH溶液反应的离子方程式_________。
(2)试剂X是_______;固体F是______。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生
的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加一个盛有饱和____溶液的洗气瓶,其作用是______。

(4)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的![]() 和
和![]() 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黄色)+2H+
(黄色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________。
(2)关于第①步反应,下列说法正确的是________(填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示:
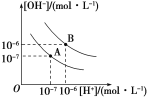
(1)若以A点表示25 ℃时水电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100 ℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[Am+]n·[Bn-]m,在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质的说法中正确的是( )
A.氢氧化钠固体溶于水后能导电,所以氢氧化钠是电解质
B.二氧化碳水溶液能够导电,所以二氧化碳是电解质
C.铁、铜能导电,所以铁、铜为电解质
D.氯化铁溶液能够导电,所以氯化铁溶液是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com