
科目: 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
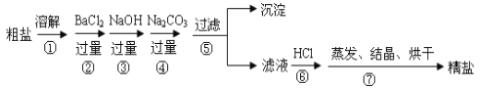
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________________________。
(2)第②步操作的目的是除去粗盐中的__________(填化学式),判断BaCl2已过量的方法是____________________________________________________________。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是________________。
(4)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、酒精灯、火柴、玻璃棒、______。
(6)第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:______________________________;
(7)第⑥步操作中涉及反应的离子方程式有:__________________、__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述不正确的是
A. CaF2晶体中Ca2+与F-的配位数之比为2:1
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为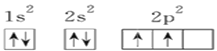
D. Z元素具有两性
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是( )
A.中国天眼传输信息用的光纤材料是二氧化硅
B.人们常利用碘化银实现人工降雨
C.港珠澳大桥用到的合金材料,具有熔点高、强度大、密度大等性能
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示, 现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2===P4O6 放出的热量为 ( )
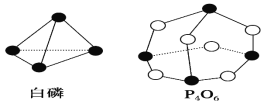
A. 126 kJB. 1268 kJ
C. 1326 kJD. 1638 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图在A中放入干燥的细铜丝,左边烧杯中放入热水,试管B中放入乙醇,右边试管C中放入冷水。向B中不断鼓入空气,使乙醇蒸气和空气通过加热至红热的铜丝。
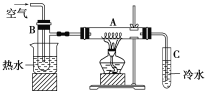
(1)A的名称为________,热水的作用是____________,本实验的目的是__________。
(2)检验乙醇中是否有水的方法为_____________,除去其中水的方法为__________;撤去A处酒精灯后铜丝仍能保持红热的原因是____________________________。
(3)反应后将试管C中的液体冷却,取出少量,滴加几滴银氨溶液,再水浴加热一段时间观察到的现象为_________________;反应方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
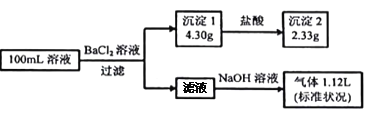
下列说法不正确的是
A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
C. 原溶液中c(Cl-)≥0.1mol·L-1
D. 原溶液一定存在Cl-,可能存在Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分类正确的是( )
A.酸:CH3COOH、H2SO3、NaHCO3、HF
B.碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2
C.盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2
D.氧化物:FeO、N2O5、COCl2、SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com