
科目: 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
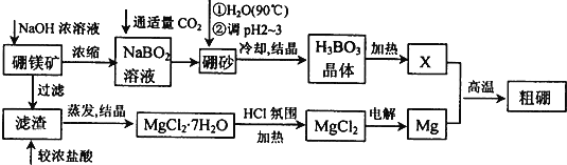
回答下列有关问题:
(1)硼砂中B的化合价为________________,溶于热水后,常用H2SO4调pH为2~3制取H3BO3,反应的离子方程式为________________________________________________________________。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_______________________________________________________________。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是______________________________________________________________。若用惰性电极电解MgCl2溶液,其总反应离子方程式为____________________________________________________________。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为____________________________________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定至终点,并选用指示剂,达到滴定终点的现象是_________________________________________。消耗Na2S2O3溶液18.00mL。该粗硼样品的纯度为__________________。(提示:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项反应对应的图像正确的是
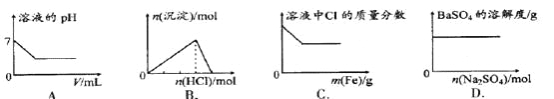
A. 25℃时,向亚硫酸溶液中通入氯气
B. 向 Na[Al(OH)4]溶液中通入 HCl气体
C. 向少量氯化铁溶液中加入铁粉
D. 向 BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是

A. 该反应中Cl-为氧化产物
B. 反应后溶液的碱性减弱
C. 消耗1 mol还原剂,转移6 mol电子
D. 该反应说明非金属性Cl>N
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质的分类或变化说法正确的是
A. Na2CO3、BaCl2是常见的强电解质,且溶于水时均会破坏水的电离平衡
B. NO2经降温加压凝成无色液体为物理变化,NO2排水收集到无色气体为化学变化
C. Na2OSiO2是一种简单的硅酸盐,露置于空气中会变质
D. 植物油可萃取溴水中的溴而使溴水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】I.元素周期表的一部分如下表所示,参照元素①~⑩在表中的位置,请回答下列问题:
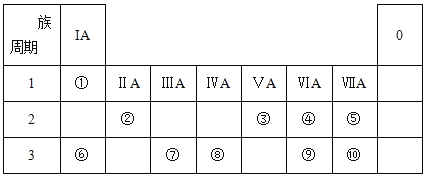
(1)⑨的阴离子结构示意图为____;③的简单氢化物与⑨的最高价氧化物对应的水化物化合生成的正盐的化学式为______。
(2)⑤和⑥形成的化合物的电子式为________。
(3)③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序为___(用化学式表示,下同)>____。
II.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。
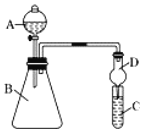
(4)干燥管D的作用是_________。
(5)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝,则C试管中发生反应的离子方程式为________。从环境保护的观点考虑,此装置的缺点是________。
(6)证明非金属性:S>C,在A中加稀硫酸,B中加碳酸钠,C中加澄清石灰水;观察到C中溶液变浑浊的现象,该实验设计的原理是利用_____来比较元素非金属性的强弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】向恒温恒容的密闭容器中充入H2(g)和I2(g)各0.1mol,发生反应H2(g)+I2(g)![]() 2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
2HI(g),该反应的能量变化如图所示。下列说法正确的是( )
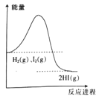
A. 该反应是吸热反应
B. 断裂0.05molH-H键和0.05molI-I键消耗的总能量小于生成0.1molH-I键释放的总能量
C. 当容器中气体密度不变时,说明反应已达到平衡状态
D. 达到平衡时,生成HI的分子数约为0.2×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下,下列说法不正确的是
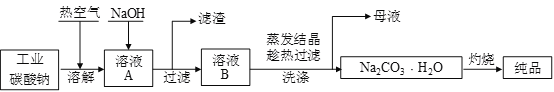
A. 步骤①,通入热空气可以将Fe2+氧化
B. 步骤②,产生滤渣的主要成分为Mg(OH)2和 Fe(OH)3
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3·H2O中混有Na2CO3·10H2O等杂质
D. 步骤④,灼烧Na2CO3·H2O在瓷坩埚中进行
查看答案和解析>>
科目: 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A. 2Na+3H+=2Na++H2↑
B. Na+H2O=Na++OH-+H2↑
C. 2Na+2H2O=2Na++2OH-+H2↑
D. 2Na+2H2O=2Na++O2↑+2H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com