
科目: 来源: 题型:
【题目】关于下列装置说法正确的是( )
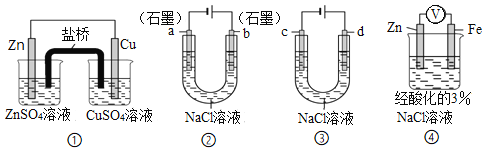
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH降低
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,Zn极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有人设想将不溶的碳酸盐材料通过特殊的加工方法使之变为纳米碳酸盐材料(即碳酸盐材料粒子直径是纳米级),这将使建筑材料的性能发生巨大变化,下列关于纳米碳酸盐材料的推测正确的是
A. 纳米碳酸盐材料是与胶体相似的分散系
B. 纳米碳酸盐材料分散到水中会产生丁达尔效应
C. 纳米碳酸盐材料的化学性质已与原来的碳酸盐材料完全不同
D. 纳米碳酸盐材料的粒子不能透过滤纸
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将体积为Va、pH=a的某一元酸HA溶液与体积为Vb、pH=b的某一元碱BOH溶液混合,请回答。
(1)若a + b=14,2Va=Vb,反应后所得溶液pH=7。则生成的盐溶液中,一定发生水解的离子方 程式为_______
(2)若a + b=12,酸是盐酸,碱是KOH,反应后所得溶液pH=7,则Va与Vb的关系是_______
(3)若酸是盐酸,碱是氨水,反应后所得溶液中离子浓度大小关系不可能是_________(填序号)
A.c(Cl-)>c(NH)>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH)
C.c(NH)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH)>c(OH-)
E.c(Cl-)=c(NH)>c(H+)=c(OH-)
(4)若酸是醋酸,碱是NaOH,且反应后混合溶液中c(CH3COO-)>c(H+),则混合溶液可能呈_____(填序号)
A.酸性 B.碱性 C.中性 D.都有可能
(5)25 ℃时,将体积Va=200 mL,pH=2的H2SO4溶液与体积Vb=10 mL、pH=11的氨水溶液混合,恰好完全反应。则此条件下,氨水的电离平衡常数是____________
查看答案和解析>>
科目: 来源: 题型:
【题目】几种主族元素在周期表中的位置如下
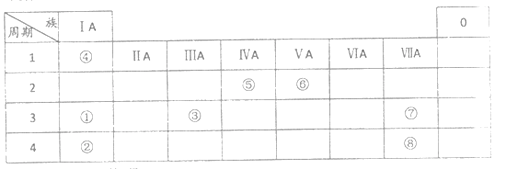
根据上表回答下列问题:
(1)⑥元素的氢化物是_________ (填化学式)
(2)①③⑦三种元素原子半径由大到小的顺序是_________(填元素符号)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_________,该元素在周期表中的位置是__________________。
(4)①②③三种元素氧化物对应水化物碱性最强的是_________(填化学式),①与水反应的化学方程式为_________。
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因:_________。下列表述中能证明这一事实的是_________ (填序号)
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物的水化物的酸性强于⑧最高价氧化物的水化物的酸性
c.⑦能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是_________ (填字母序号)
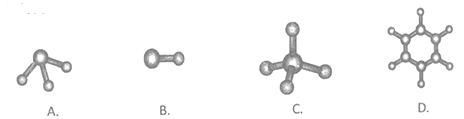
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用铁电极包解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO3-+H2O
C. 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+
D. 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
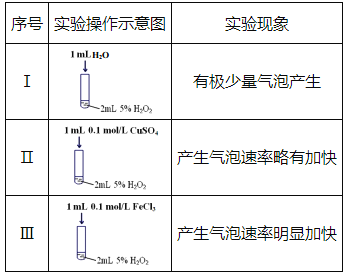
(1)实验I的作用是_________。
(2)实验III中反应的化学方程式为_________。
(3)根据实验I~III中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②___________________________。
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,6min后H2O2的浓度减小到0.10mol/L,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com