
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍等金属单质及化合物有广泛的应用。
(1)已知锂离子电池总反应方程式是FePO4(s)+Li(s) ![]() LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
LiFePO4(s)。请写出Fe3+的电子排布式____________,PO43-离子中p原子杂化轨道类型____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
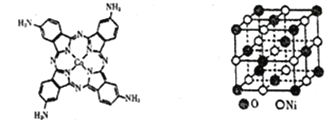
①一个电子的运动状态取决于______种因素,基态Co原子中空间运动状态不同的电子数为___种。
②氨基钴酞菁中非金属元素的电负性从大到小的顺序为_________
③“氨基钴酞菁”比“钴酞菁”显著溶于水,请简述其原因_______。
(3)K3[Co(NO2)6]中存在的化学键类型有____________,配位数为_______。
(4)Sr和Ca为同族金属元素,CaO与SrO熔点更高、硬度更大,请简述原因______。
(5)如上图所示为NiO晶体的晶胞示意图:
①该晶胞中与一个Ni最近等距离的O构成的空间几何形状为____________________。
②在NiO晶体中Ni2+的半径为apm,O3-的半径为bpm,假设它们在晶体中是紧密接触的,则其密度为___g/cm3。(用含字母a、b的计算式表达)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程中,不属于氮的固定的是( )
A. 闪电时,N2变为NO B. NO被空气中O2氧化为NO2
C. 工业上,用N2合成氨 D. 豆科植物根瘤菌把N2变成NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为436kJ·mol-1,N—H键的健能为391kJ·mol-1,N![]() N键的键能是945.6 kJ·mol-1,则反应NH3(g)
N键的键能是945.6 kJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=______,若在某温度下其平衡常数为K,则N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K1=___________(用K表示)
2NH3(g)的平衡常数K1=___________(用K表示)
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。
(1)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式_______________________。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是________点( 填“A” “B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=_____________(Kp是平衡分压代替平衡浓度计算,分压= 总压×物质的量分数。)

(2)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() =
=![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
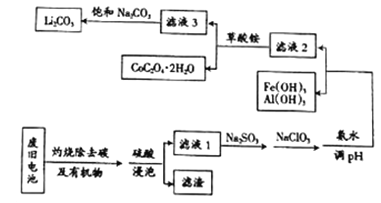
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
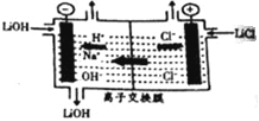
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
A. υ(D)=0.4 mol / (L·s)
B. υ(C)=0.5 mol / (L·s)
C. υ(B)=0.6 mol / (L·s)
D. υ(A)=0.15 mol / (L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.氯化钠B.固体硝酸钾C.生石灰D.固体氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com