
科目: 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
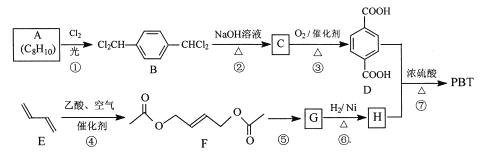
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目: 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
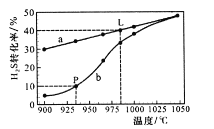
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】pC类似pH,是指溶液中溶质物质的量浓度的常用对数的负值,如某溶液的浓度为1×10-2mol/L,则溶液中该溶质的pC=-lg1×10-2=2。已知H2RO3溶液中存在的化学平衡为:
RO2(g)+H2O ![]() H2RO3
H2RO3 ![]() H+ +HRO3- ,HRO3-
H+ +HRO3- ,HRO3-![]() H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
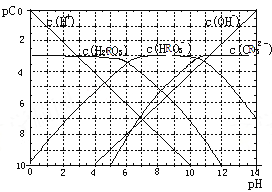
(1)在pH=2~4时,H2RO3溶液中主要存在的离子为:_____;
(2)H2RO3一级电离平衡常数的数值Ka1≈_______;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11。观察上图判断NaHRO3溶液呈_______性;再通过计算,利用电离、水解平衡常数说明理由____________。
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是_________ 。
(5)一定温度下,三种盐MRO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解曲线如图所示。已知:p(M2+)=-lg c(M2+),p(RO32-)= -lgc(RO32-)
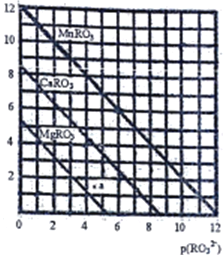
①MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为__________________。
② a 点时c(Mg2+)_____ c(RO32-) (填“>”或“<”或“=”),此时MgRO3溶液__________(填“己达饱和”或“未达饱和”)
③现欲将某溶液中的Mn2+以MnRO3盐的形式沉淀完全(溶液中Mn2+离子的浓度小于l×10-5mol/L),则最后溶液中的p(RO32-)的范围是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)画出f的原子结构示意图________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_____;比较g、h的最高价氧化物对应水化物的酸性强弱:______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________。
Ⅱ.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是第________周期、第________族。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是____,碱性最强的是____(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A的产量是衡量一个国家石油化工发展水平的标志。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:

已知:RCHO ![]() RCOOH
RCOOH
(1)A分子的结构简式为______;D中官能团名称为______。
(2)在反应①~⑥中,属于加成反应的是______,属于取代反应的是______(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有______、______;分离提纯混合物中的G所选用的的试剂为______,实验操作为__________。
(4)写出下列反应的化学方程式:
②B→C:____________;
④B+D→G:______________;
⑥A→F:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是______(填字母代号),负极Zn发生了_____反应(填“氧化”或“还原”)。
(2)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是_______(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置负极的电极反应式___________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修5有机化合物】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

已知:
请回答:
(1)写出下列反应方程式
①B+D→E______________________________________。
②G→H________________________________________。
(2)①的反应类型为__________;②的反应类型为__________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com