
科目: 来源: 题型:
【题目】收集NO和NO2两种气体( )
A. 都可用排水法 B. NO用排水法,NO2用向上排气法
C. 都可用向上排气法 D. NO用向上排气法,NO2用排水法
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有下列几组物质:A. ![]() B. 丙烷和己烷 C. 正丁烷和异丁烷 D. CH3CH3和CH3(CH2)8CH3
B. 丙烷和己烷 C. 正丁烷和异丁烷 D. CH3CH3和CH3(CH2)8CH3
E.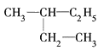 和
和![]() F.
F.![]() 和
和![]()
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;
④属于同系物的是________________;
(2)已知某烷烃分子相对分子质量为72。
①该烷烃的分子式为______________;
②写出该烷烃分子所有的同分异构体的结构简式____________________________;
③上述同分异构体中,在相同条件下沸点最低的是_____________________________(写结构简式);
(3) 已知![]() 的苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物有______种;
的苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物有______种;
(4)下列各种醇不能发生催化氧化的是_______ 。
A. CH3OH B. CH3CH2OH C. CH3CH(CH3)OH D. CH3CH2C(CH3)2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
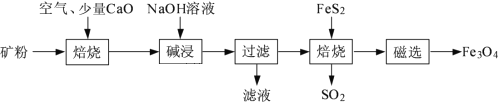
(1)流程中将高硫铝土矿磨成矿粉的目的是_________________________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
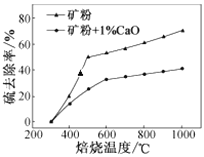
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1—![]() )×100%。
)×100%。
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________。
(3)由“过滤”得到的滤液生产氧化铝的反应过程中涉及的离子方程式是______________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应, 生成两种不同的有机物, 且这两种有机物的相对分子质量相等, 该有机物可能是
A.蔗糖B.麦芽糖C.乙酸乙酯D.甲酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
C. 每消耗1molX同时生成2mol Z,说明反应已达平衡
D. 反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目: 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )

A. a处通入氧气,b处通入氢气
B. 该装置中只涉及两种形式的能量转化
C. P一型半导体连接的是电池负极
D. 电池正极电极反应式为O2+2H2O+4e—=4OH—
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
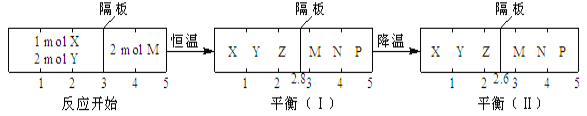
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实促熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为____________________,A的结构简式为____________________。
(2)A可以使溴的四氯化碳溶液褪色的化学反应方程式为: _________,反应类型为__________。
(3)在碘水中加入B振荡静置后的现象为___________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式为: ___________,反应类型为__________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__________(填"A>B""A<B"或"A=B")。
查看答案和解析>>
科目: 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com