
科目: 来源: 题型:
【题目】⑴某研究学习小组的同学对乙烯使溴水褪色的本质原因提出两种不同的观点:甲观点认为,乙烯与溴单质发生加成反应;乙观点认为,乙烯与溴单质发生取代反应。请你设计简单的实验方案来确认哪种观点正确___________________________________________________________。
⑵在一定条件下.萘可以和硝酸、硫酸的混合酸发生硝化反应,生成二硝基物.
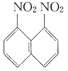
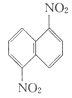
它是1.5一二硝基萘和1.8一二硝基萘的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能;又知两同分异构体是都难溶于水和稀酸。利用这一特性将这两种异构体分离。请写出你设计的实验步骤:
⑴______________________________________________________________。
⑵______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

请回答下列问题:
(1)反应I的化学方程式为_____________________________________。1mol H2SO4(液)分解成气态物质需要吸收的能量是275.5kJ,硫的燃烧热为297 kJ·mol-1,则反应Ⅱ的热化学方程式为________________________________。
(2)单质硫也可以生成多硫化物实现能量间的转化。
①钠硫电池是一种新型高能电池,总反应为2Na+xS ![]() Na2Sx,该电池工作时的正极反应式为____________________,给该电池充电时,钠电极应与外电源的____________(填“正”或“负”)极相连接。
Na2Sx,该电池工作时的正极反应式为____________________,给该电池充电时,钠电极应与外电源的____________(填“正”或“负”)极相连接。
②多硫化合物H2S2O8中S的化合价为+6,分子中过氧键的数目为______________________。
③在碱性溶液中,多硫离子Sx2-被BrO![]() 氧化成SO
氧化成SO![]() ,
,![]() 被还原成Br-。该反应的离子方程式是________________________。
被还原成Br-。该反应的离子方程式是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定的条件下氧化只生成G,G能使石蕊试液变红
已知:
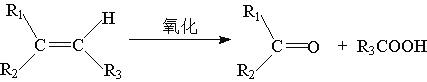
(1)A的分子式_______________。化合物G的结构简式: G____________。
⑵A分子至少有_________个碳原子共平面。A分子加氢后生成的烷烃的一氯取代物
有_________种。A分子能使溴的四氯化碳溶液褪色,生成的产物有_______________种手性碳。
查看答案和解析>>
科目: 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
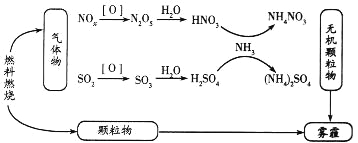
回答下列问题:
(1)NH3的电子式为____________,NH4NO3中含有的化学键是________________:
(2)下列关于雾霾的叙述错误的是________(填序号)
A.雾霾中含有硝酸铵和硫酸铵 B.NH3是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入O2充分反应生成一种正盐,该反应的化学方程式为________________________。预防含氮化合物雾霾生成的方法之一是用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,电解后该溶液的pH_______(填“变大”“变小”或“不变”)。
(4)在有氧条件下,催化剂能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,NOx的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是__________________________。在无氧条件下,反应器中NH3能将NO2还原为N2,当生成1mol N2时转移电子________mol(可用分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】烷烃可以由相应的烯烃经催化加氢得到,有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,分别可以而且只能由一种相应的烯烃催化加氢得到,推断并写出A、B1、B2、B3的结构简式为:A________,B1______________,B2__________,B3_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
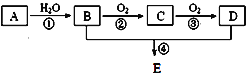
(1)步骤①的化学方程式_____________,反应类型____________。步骤②的化学方程式_____________________,反应类型____________。
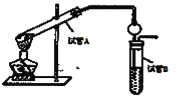
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_____________。
②试管B中的试剂是__________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2![]() CH3CH2Cl+HCl。
CH3CH2Cl+HCl。
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl ![]() CH3CH2Cl。
CH3CH2Cl。
你认为上述两位同学的方案中,合理的是________(选填“甲同学”或“乙同学”),简述你的理由:____
查看答案和解析>>
科目: 来源: 题型:
【题目】I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
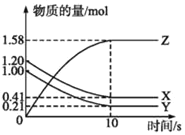
(1)写出该反应的化学方程式___________________
(2)下列叙述中不能说明上述反应达到平衡状态的是___________.
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是_____.
A 恒压时充入Ne B 适当升高温度
C 缩小容器的体积 D 选择高效催化剂.
II.一定温度下将3mol的A及3molB混合于2L的密闭
容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.18mol/(L.min)。
求:(1)平衡时B的浓度=______mol/L。
(2)D的平均反应速率υ(D)=______mol/( L.min)。
(3)x=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:_________。
(2)③⑤⑧的原子半径由小到大的顺序为__________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为___________。
(5)用电子式表示⑥和⑨形成的化合物的过程:________________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象________,即可证明。请写出一种制取氯气的化学反应方程式:_______,从环境保护的角度考虑,此装置缺少尾气处理装置,可用___________溶液吸收尾气。
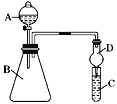
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液__________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com