
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A. 2v (NH3)=v (CO2)
B. 密闭容器中气体密度不变
C. 密闭容器中混合气体的平均摩尔质量不变
D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因__________。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是___________。
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;
③三颈烧瓶中装入150mL CCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性。
正确的顺序为:__________________________。

(4)用如图装置制备CrCl3时,向三颈烧瓶中通入N2的作用为_______________________________
(5)制备CrC13时生成的气体COCl2(俗称光气)有毒,COCl2遇水发生水解,反应方程式为COCl2+H2O═CO2↑+CHCl,为了防止污染环境,用NaOH溶液吸吸收光气,其化学方程式为____________________________________________________________。
(6)仔细分析整套装置,为了制取并收集到纯净的CrCl3,明显有一个不足之处,你认为应该改进的一项措施是__________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)高分子PMMA是迄今为止合成透明材料中质地最优异、价格又比较适宜的品种。其中一种合成路线如图。

(1)A的分子式是_________。
(2)反应II的化学方程式是_________。
(3)H是E的同分异构体,它同时符合下列条件:①能发生银镜反应;②能与H2发生加成反应;③不能发生水解反应;④分子内不含甲基。则H可能的结构简式为_________(写出任意一种)。
(4)MMA通过加聚反应制取PMMA的化学方程式是_________。
(5)已知:
 (R1、R2代表烃基或H)。
(R1、R2代表烃基或H)。
以2-丙醇(![]() )为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_________。
)为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2000多年前,希腊生理学家和医学家希波克拉底发现,杨树、柳树的皮、叶中含有能镇痛和退热的物质。1800年,人们开始从该类植物中提取药物的活性成分——水杨酸(![]() )。1853年,德国化学家柯尔柏合成了水杨酸,并于1859年实现工业化生产。水杨酸虽然解热和镇痛效果很好,但由于酚羟基的存在,对肠道和胃粘膜有强烈的刺激,易引发呕吐和胃出血,而且味道令人生厌。1898年,德国化学家霍夫曼利用反应:
)。1853年,德国化学家柯尔柏合成了水杨酸,并于1859年实现工业化生产。水杨酸虽然解热和镇痛效果很好,但由于酚羟基的存在,对肠道和胃粘膜有强烈的刺激,易引发呕吐和胃出血,而且味道令人生厌。1898年,德国化学家霍夫曼利用反应:

制得乙酰水杨酸(阿司匹林),改善了水杨酸的疗效。1899年,由德国拜尔公司开始生产,并应用于临床,是第一种重要的人工合成药物。现代医药发展方向之一是合成药物长效化和低毒化,其有效途径是低分子药物高分子化,如:可将药物分子连在安全无毒的高分子链上。1982年,科学家通过乙二醇的桥梁作用把阿司匹林连接在高聚物上,制成缓释长效阿司匹林( ),用于关节炎和冠心病的辅助治疗。缓释长效阿司匹林分为高分子载体、低分子药物和作为桥梁作用的乙二醇三部分,在肠胃中水解变为阿司匹林,缓释长效阿司匹林使这种“古老”的解热镇痛药物重新焕发了“青春”。
),用于关节炎和冠心病的辅助治疗。缓释长效阿司匹林分为高分子载体、低分子药物和作为桥梁作用的乙二醇三部分,在肠胃中水解变为阿司匹林,缓释长效阿司匹林使这种“古老”的解热镇痛药物重新焕发了“青春”。
根据上述材料,结合所学知识,回答以下问题。
(1)水杨酸具有________和________的作用。
(2)霍夫曼制取阿司匹林的反应类型是________。
(3)在霍夫曼制取阿司匹林的反应中,可用于检验水杨酸是否完全反应的试剂是________。
(4)写出缓释阿司匹林在肠胃中水解出阿司匹林的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 64g SO2中含有的原子数为3NA
B. 5.6g金属铁变为离子时失去的电子数为0. 3NA
C. 常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 1mol/L NaOH溶液中Na+的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。

(1)操作I、II中,不会用到的装置是________(填序号)。

(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。
(3)操作III的目的是_________。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______>__________;________比较g、h的最高价氧化物对应水化物的酸性强弱:_______>__________。____________
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:
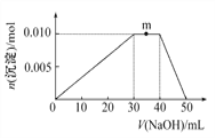
①写出m点反应的离子方程式:____________________________。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。

2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
(1)利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数KΘ=![]() ,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则KΘ=_____________(用含w的最简式表示)
②下图中可以示意标准平衡常数KΘ随温度T变化趋势的是_______。
 (3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________。
②关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

(1)请写出“化学法”得到FeO42-的离子方程式___________________________。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com