
科目: 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
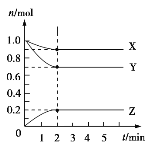
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2 ![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(1),△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
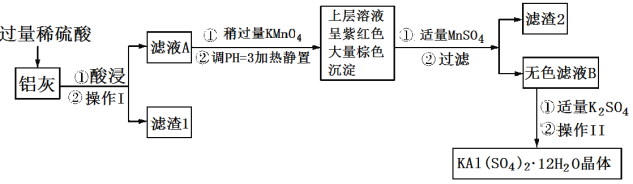
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO![]() 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.碘易升华,可保存在酒精中
B.液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
C.新制的氯水可长期保存在无色玻璃瓶中
D.碘易溶于酒精,所以可用酒精从碘水中萃取碘
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
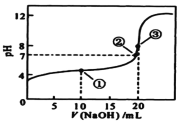
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是( )
A. 生成Cl2的平均反应速率,0~2s比2~4s快B. 0~2s COCl2的平均分解速率为0.15mol·L-1·s-1
C. 6s时,反应达到最大限度D. 该条件下,COCl2的最大转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com