
科目: 来源: 题型:
【题目】反应Fe+H2SO4 ═ FeSO4+H2↑的能量变化趋势,如图所示:
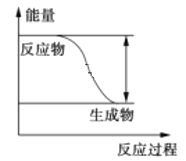
(1)该反应为______反应(填“吸热”或“放热”)
(2)若要使该反应的反应速率加快,下列措施可行的是______(选填A、B、C)。
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸溶液 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”),铜片上产生的现象为______,该极上发生的电极反应为______,消耗5.6g Fe时转移的电子数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是 ( )

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
D. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在某一容积为2 L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:

回答下列问题:
①该反应的化学方程式为__________________________________。
②前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因是________(填字母)。
A.增大压强 B.降低温度 C.加入催化剂 D.增加A的物质的量
(2)在100 ℃时,将0.01 mol的四氧化二氮气体充入0.1 L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式________________________________,达到平衡时四氧化二氮的转化率为_______。
②在0~20 s内,四氧化二氮的平均反应速率为______,哪一时间段______(指0~20、20~40、40~60、60~80、80~100 s)反应速率最大并解释______。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述正确的是

A. 溶液中的K+移向b电极
B. a极的电极反应式为:2H++2e—= H2↑
C. b极为负极,该电极上发生氧化反应
D. 电子由a极经电解质溶液移向b极
查看答案和解析>>
科目: 来源: 题型:
【题目】将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________mol/(L·s)。
(2)反应前A的物质的量浓度是________________mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
编号 | 改变的条件 | D的生成速率 |
① | 降低体系温度 | ______ |
② | 恒容下补充A气体 | ______ |
③ | 恒容下充入Ne(不参与体系反应) | ______ |
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
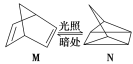 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com