
科目: 来源: 题型:
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较![]() 和
和![]() 对
对![]() 分解反应的催化效果,甲、乙两位同学分别设计了如图中甲、乙所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲、乙两位同学分别设计了如图中甲、乙所示的实验。下列叙述中不正确的是![]()
![]()

A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则说明![]() 一定比
一定比![]() 对
对![]() 分解的催化效果好
分解的催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某同学设计如图所示装置探究氯气能否与水发生反应。气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
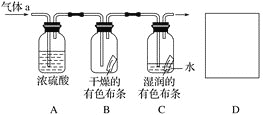
(1) 浓硫酸的作用是_____________________________。
(2) 证明氯气和水发生反应的实验现象为_________________________。
(3) 该实验设计存在的缺陷是____________________,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_________________________。
II.如图为浓硫酸与铜反应及其产物检验的实验装置
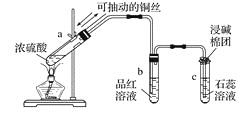
回答下列问题:
(1) 指出试管b、c中产生的实验现象:b中___________________;c中______________________。
(2) 反应结束后试管a中有部分白色固体,将a试管中的溶液慢慢倒入水中,发生的变化是___________。
(3) 写出浓硫酸与铜反应的化学方程式:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
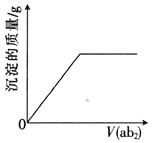
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目: 来源: 题型:
【题目】I 用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O。
2Cl2+2H2O。
已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)H2O的电子式是______________________。
(2)反应A的热化学方程式是_________________________________________________。
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
II 在一定条件下,可逆反应A2(g) + B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
(1)a、b应满足的关系是________________________________;
(2)a的取值范围是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 乙醇常被用做饮料的添加剂,在一定的条件下能被氧化为乙醛,乙醇氧化为乙醛的反应方程式为________________;乙醇_________(“能”或“不能”)使酸性KMnO4溶液褪色;已知常温下,2.3 g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35 kJ热量,则该反应的热化学方程式为_______________________。
(2) 已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为________ kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为________ kJ·mol-1。
(3) 已知水的比热容为4.18×10-3 kJ·g-1·oC-1。10 g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18 ℃升至62.4 ℃,则硫黄的燃烧热为_____________,热化学方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,用0.1000mol·L-1稀硫酸滴定20.00mL 0.1000mol·L-1氨水,溶液中水的电离程度随所加稀硫酸体积的变化如图所示。下列说法不正确的是
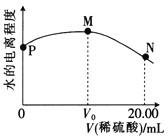
A. 该实验可选择甲基橙作指示剂
B. 从P点到N点,溶液中水的电离程度先增大后减小
C. M点对应的溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. N点对应的溶液中:c(NH4+)+c(NH3·H2O)=2c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中一定正确的是( )
A. 元素非金属性比较为:![]()
B. W、X、Y、Z原子的核外最外层电子数的总和为20
C. W与Y可形成既含极性共价键又含非极性共价键的化合物
D. 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】在298 K、101 kPa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(4x-y) kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(2y-x) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com