
科目: 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:

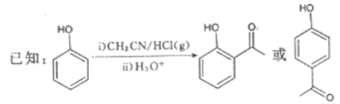
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】某烷烃的1个分子中含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( )
A.正壬烷B.2,6-二甲基庚烷
C.2,2,4,4-四甲基戊烷D.2,3,4-三甲基己烷
查看答案和解析>>
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
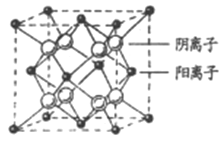
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
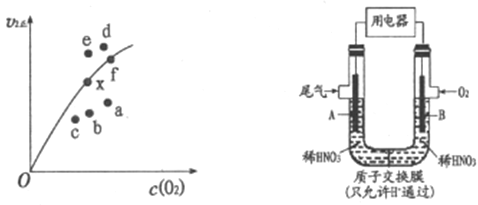
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的容器中进行反应2SO2+O2![]() 2SO3,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需20s,那么由0.06 mol·L-1降到0.024mol·L-1需要的反应时间为
2SO3,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需20s,那么由0.06 mol·L-1降到0.024mol·L-1需要的反应时间为
A. 等于18sB. 等于12sC. 大于18sD. 小于18s
查看答案和解析>>
科目: 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. 由于CaO+H2O![]() Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
B. 当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快
C. 原电池的电极附近溶液pH的变化可以用电池总反应式来判断
D. 铅蓄电池放电时的正极反应式为PbO2 +4H+ +2e-![]() Pb2+ +2H2O
Pb2+ +2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质,互为同系物的是
A. CH3CH=CH2与CH3CH3B.  与
与 ![]()
C. CH3CH2OH 与CH2OHCH2OHD. C3H8和C5H12
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中繁衍着无数水生生物,海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤①的实验操作名称是________;
(2)现有烧杯、玻璃棒以及必要的夹持仪器、物品。完成步骤①的实验尚缺少的玻璃仪器是_________________,步骤③中的萃取剂可选择________________
(3)步骤②中反应的离子方程式是______________________________;
(4)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M: Mg2+ 、Ca2+ 、Mn2+)的沉淀溶解平衡曲线如下图所示。下列说法正确的是

已知pM=-lgc(M),p(CO32-)=-lgc(CO32-)。
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)< c(CO32-)
D. c点可表示MgCO3的过饱和溶液,且c(Mg2+)< c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com