
科目: 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用如下图所示装置完成了浓硫酸和SO2的性质实验(夹持装置已省略)。请回答下列问题

(1)将螺旋状的铜丝伸入浓硫酸中,发生反应的化学方程式为____________。
(2)实验中,试管Ⅱ中的品红溶液_____________(填现象)。
(3)下列说法不正确的是_______(填字母代号)
A.反应后,将试管I中的液体逐滴加入水中,溶液呈蓝色 B.试管Ⅲ中出现白色浑浊
C.试管Ⅳ中的酸性KMnO4溶液褪色 D.试管V中的NaOH溶液用于吸收尾气
(4)若反应中有0.02 mol H2SO4被还原,则反应产生的气体体积为______mL(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着原子序数的递増,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如下图所示。请根据判断出的元素回答下列问题

(1)f在元素周期表中的位置是第三周期第____族。
(2)比较d、e常见离子的半径大小:_______(用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱:_______
(3)写出x与z形成的常见四原子共价化合物的电子式_______
(4)物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且y元素与x元素的质量比为12:1,A的相对分子质量为78。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为__________,反应类型为__________。
(5)f的最高价氧化物对应的水化物可以与e的最高价氧化物对应的水化物反应,请写出该反应的离子方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL 0.25mol/LH2SO4溶液与50mL 0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)①烧杯间填满碎泡沫塑料的作用是_____________。
②若大烧杯上改为盖薄铁板,求得的反应热数值:_______(填“偏大”、“偏小”或“无影响”)。
③若通过测定计算产生的热量为1.42kJ,请写出表示中和热的热化学方程式:____________。
(2)上述实验数值与57.3 kJ/mol有偏差,产生偏差的原因可能是______(填字母)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液例入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ/mol
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据,则NH3(g)![]() l/2N2(g)+3/2H2(g) △H=_________kJ/mol。
l/2N2(g)+3/2H2(g) △H=_________kJ/mol。
化学键 | H-H | N-H | N≡N |
键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中属于氧化还原反应,伹水既不作氧化剂又不作还原剂的是
A.SO3+H2O=H2SO4B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如下图所示。

(1)富集溴一般先用热空气或水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为_____________________。
(2)为了使Mg2+转化为Mg(OH)2,试剂①可以用_________________(填化学式)
(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_______。
(4)下列有关海水综合利用的说法错误的是_____(填字母代号)。
A.粗盐可采用除杂和结晶等过程提纯 B.电解饱和食盐水可制得金属钠
C.向滤液中通入C12是为了氧化Br- D.海水提镁过程中涉及复分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水里可以提取溴,主要反应为2Br﹣+Cl2=2Cl﹣+Br2,下列说法正确的是( )
A.溴离子具有氧化性B.氯气是还原剂
C.该反应属于复分解反应D.Br2是氧化产物
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
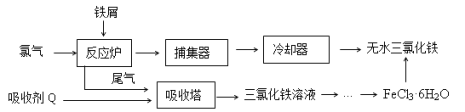
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸, 再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
⑴ 将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH 1 = +489.0 kJ·mol-1
C(石墨) + CO2(g) =2CO(g) ΔH 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________________。
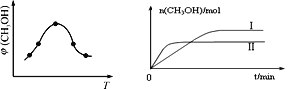
⑵ 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
① 取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应ΔH_______0(填“>”、“<”或“=”)。
② 在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为:KⅠ______KⅡ(填“>” 或“<”)。
⑶ 以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为_____________________________________。当氨碳比n(NH3 )/n(CO2 )=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com