
科目: 来源: 题型:
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

如图是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________________。

(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH
CH3OCH3 (g)+H2O(g) ΔH
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。

① a、b、c按由大到小的顺序排序为_______________;ΔH_____0(填“>”“<”或“=”)。
② 对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_________________________。
③ 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_____。
A.一氧化碳的转化率减小
B.容器的压强增大
C.化学平衡常数K值减小
D.逆反应速率先增大后减小
E.混合气体的密度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)2HI(g)△H=-9.48kJmol-1
②H2(g)+I2(?)2HI(g)△H=+26.48kJmol-1
下列判断不正确的是( )
A.![]() 中的I2为气态,
中的I2为气态,![]() 中的I2为固态
中的I2为固态
B.![]() 的反应物总能量比
的反应物总能量比![]() 的反应总能量低
的反应总能量低
C.1mol固态碘升华时将吸热35.96kJ
D.反应![]() 的产物比反应
的产物比反应![]() 的产物热稳定性更好
的产物热稳定性更好
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:
Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________
已知:(在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠,溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸,溶液呈___________色。
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用
B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________
②表中Vx=_______mL,比较t1、t2、t3大小____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 蒸发结晶操作时,为了得到纯净的晶体应将溶液蒸干
D. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )


A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目: 来源: 题型:
【题目】金属-空气电池是以金属为燃料,与空气中的氧气发生氧化还原反应产生电能的一种特殊燃料电池。如图为钠-空气电池的装置示意图,其中电解液为含NaPF6的有机电解液,可传导Na+.下列说法正确的是( )
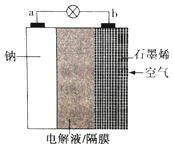
A.装置中电子转移途径:![]() 导线
导线![]() 电解液
电解液![]()
B.b电极为正极,发生还原反应
C.可用氯化钠水溶液代替该有机电解液
D.b电极的电极反应式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com