
科目: 来源: 题型:
【题目】下列有关图示的分析中,不正确的是

A.如果该图为组成活细胞中的元素,则A是氧元素
B.如果该图表示的是组成细胞的化合物,则A是蛋白质
C.如果该图表示的是活细胞中的元素,则其中Mo的含量很少
D.如果该图为组成细胞的有机化合物,则A中肯定含有的元素为C、H、O、N
查看答案和解析>>
科目: 来源: 题型:
【题目】新康泰克能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其有效成分为伪麻黄碱。伪麻黄碱D的一种合成路线如下:
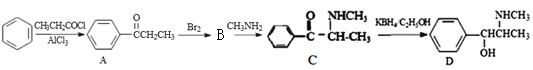
回答下列问题:
(1)苯的质谱图中最大的质荷比为___________,伪麻黄碱D的分子式为____________。
(2)写出由苯生成A的化学方程式:___________________________________________,其反应类型为_________________。
(3) B的结构简式为____________。
(4)满足下列要求的C的同分异构体有___________种;
①属于苯的一元取代物; ②含有-CONH-,且无-NH2 ;③不能发生银镜反应;其中苯环侧链的核磁共振氢谱有3组峰,且峰面积之比为6:1:1的一种有机物的结构简式为_________________。
(5)已知:![]() 参照上述合成路线,设计一条由苯和乙酸为起始原料制备的合成
参照上述合成路线,设计一条由苯和乙酸为起始原料制备的合成 路线:____________________________________。
路线:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。已知:制取氨气的反应原理为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O

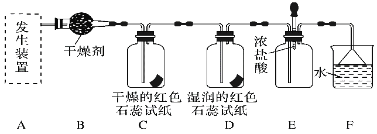
[实验探究]
(1)利用上述原理,实验室制取氨气应选用下图中________(填序号)发生装置进行实验。
(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”)。
(4)F装置中倒置漏斗的作用是___________________________________。
(5)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:![]()
已知:i. 反应A中,4mol HCl被氧化,放出115.6kJ的热量。
ii.
![]()

①HCl的电子式是__________。
②反应A的热化学方程式是____________。
③断开1mol H-O键与断开1mol H-Cl键所需能量相差约______kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)_____。
(2)下图是容积均为1L,分别按4种投料比[n(HCl):n(O2)]分别为1:1、2:1、4:1、6:1进行投料,反应温度对HCl平衡转化率影响的曲线。

①曲线c对应的投料比是__________。
②用平衡移动的原理解释温度和HCl平衡转化率的关系__________。
③投料比为4:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_____,O2的平衡转化率______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q五种元素,它们的原子序数依次增大, 已知W与其余四种元素既不同周期也不同主族;X和Z的基态原子的核外电子均排布在3个能级上,且均有2个未成对电子;Q元素原子质子数为29。
(1)按电子排布,Q元素在周期表中属____________区。
(2)第一电离能Y______Z,电负性Y______Z(填“>”,“=”或“<”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2;W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为______,YW3分子的立体构型为_____,YW3极易溶于W2Z的主要原因有___________________。(写出两点即可)
(4)Q+基态核外电子排布式为________________________________。
(5)Q+与Y3-形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏加德罗常数用NA 表示,则晶体的密度为_____________g·cm-3。
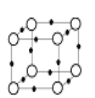
o-Y3- -Q+
查看答案和解析>>
科目: 来源: 题型:
【题目】某酒厂生产的一种白酒醇香浓厚,其标签上标有“55°”的字样,它表示( )
A.该酒是在温度为55℃的条件下酿造的
B.喝了该酒后,人体温度可达到55℃
C.该酒的沸点为55℃
D.该酒中乙醇的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
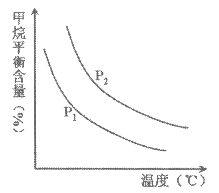
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家已经发明利用眼泪,检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4·2H2O)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒。下列有关说法不正确的是( )
A.葡萄糖不能发生水解反应
B.葡萄糖属于单糖
C.检测时NaAuCl4发生氧化反应
D.葡萄糖可以通过绿色植物的光合作用合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com