
科目: 来源: 题型:
【题目】“绿色化学”提倡化工生产中应尽可能将反应物的原子全部利用,从根本上解决环境污染问题。在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是
A.3HOCH2-CH2OH +HOCH2CH2-O-CH2CH2OH+2H2O
+HOCH2CH2-O-CH2CH2OH+2H2O
B.CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O
+CaCl2+H2O
C.CH2=CH2+ (过氧乙酸)→
(过氧乙酸)→ +CH3COOH
+CH3COOH
D.2CH2=CH2+O2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,浓度最大的阳离子是Na+
D. 在 A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
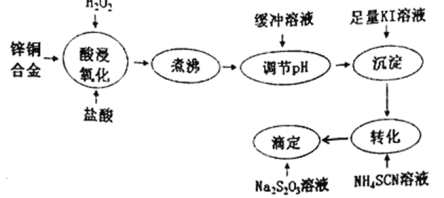
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如右图所示(反应条件及其他物质已经略去):![]() 。
。
(1)若A为淡黄色固体单质,且D为强酸
①B物质通常用________________(填试剂名称)来检验。
②从组成物质的元素化合价变化角度预测B可能具有的性质_______________ ,并用相应的化学方程式表示你预测的性质_________________________________________。
③一定条件下D转化为B有多种途径,写出其中一种D→B转化的化学方程式
______________________________________________________。
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,D的稀溶液能使湿润的蓝色石蕊试纸变红。
①写出实验室制取A的化学方程式______________________________________。
②B、C都是大气污染物,它们对环境造成的危害表现在_______。
A 引起酸雨 B 引起温室效应 C形成光化学烟雾 D引起水体富营养化
③写出C→D转化的离子方程式_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠( NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、水处理、杀菌灭藻、鱼药制造等行业。工业上可采用过氧化氢法,即在碱性条件下,用H2O2还原ClO2制备 NaClO2。某兴趣小组模拟工业生产流程在实验室中制备NaClO2,实验装置如图1所示。回答下列问题:
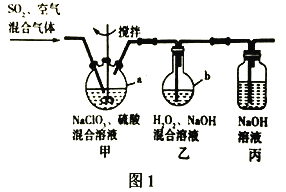
已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
①检査装置气密性;②称取10.65 g NaClO3加入200mL稀硫酸中,溶解,然后转移到仪器a中;③量取适量H2O2加入100 mL NaOH浓溶液中,摇匀后转移到仪器b中;④连接好装置进行实验。
(1)装置甲中空气并不参与反应,则装置甲中发生反应的离子方程式是___________。
(2)进行实验时,需要对装置甲进行水浴加热,水浴加热的优点是________________。
(3)装置丙的作用是_______________________________________________________。
(4)装置乙中制取 NaClO2的离子方程式_________________________________。
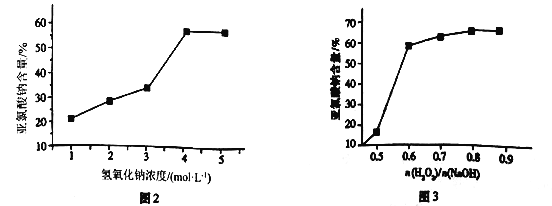
(5)仪器b中的溶质浓度对产品含量起到关键作用,溶质浓度对产品含量的影响如图2和图3所示。结合两图信息,此时混合液中n(H2O2)/n(NaOH)=___________时为最佳,且H2O2的浓度为___________mol·L-1,其可能原因是_________________________________。
(6)实验结束后,在适当的条件下处理b中的混合液,得到产品NaClO2·3H2O 9.39g。该实验的产率为___________。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对反应现象的描述错误的是( )
A. 浓硫酸加入到蔗糖中,蔗糖变黑并体积膨胀。
B. 将铜丝伸入浓硝酸中,产生红棕色气体
C. 将二氧化硫通入品红溶液中,溶液褪色
D. 氢气在氯气中燃烧,产生淡蓝色火焰
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是高中阶段学习的四种物质,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C、D是刚学过的两种有重要用途的物质,化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由一种活泼金属与氧气燃烧得到。回答下列问题:
(1)单质A与单质B反应的化学方程式:__________。
(2)单质B与水反应的化学方程式:_____________。
(3)D用于呼吸面具中,发生反应的化学方程式:_________。
(4)C与NaOH溶液反应的化学方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.含碳元素的化合物都是有机物
B.有机物都难溶于水
C.有机化合物与无机化合物的性质完全不同
D.大多数有机物受热易分解,但有的具有较强热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】中学化学学习过的一些气体可以用如图装置分别制取、干燥和收集,烧杯中的NaOH溶液用于吸收尾气。根据要求回答以下问题。

(1)请分析能用该装置制取、干燥、收集和吸收的气体对反应物、反应条件及气体性质必须符合的要求:
①对反应物的要求:____________;
②对反应条件的要求:___________;
③对生成气体性质的要求:___________。
(2)实验室用高锰酸钾和浓盐酸在如图装置中制取氯气。请回答:
①B中盛放的药品名称是_____;
②C中的现象是________;若C中出现______的现象时,说明反应中没有氯气生成。
③NaOH溶液的作用是_______,反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是_____,b过程中的化学方程式为_____。
(3)久置的氯水变为____,用化学反应方程式表示为______。
(4)实验室保存饱和氯水的方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com