
科目: 来源: 题型:
【题目】向20mL 0.5mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法错误的是

A. 从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+)
B. 由水电离的c(H+):b点>c点
C. NH3·H2O的电离程度:b点>a点
D. b点到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
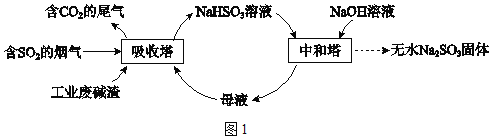
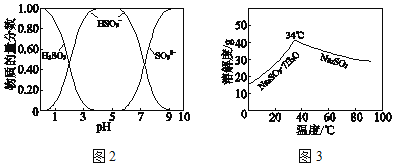
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
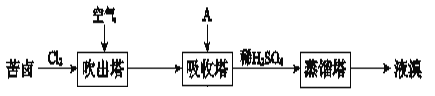
(1)Cl2和苦卤中的Br﹣反应生成Br2的离子方程式是_____。
(2)结合元素周期律解释Cl的非金属性强于Br的原因:_____。
(3)吸收塔中,A吸收了Br2后的溶液中含有Br﹣和BrO3﹣,则A是_____(填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
(4)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.cbdD.abcd
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A. HCO3-+H2O H3O++CO32- B. NH3+H2O OH-+NH4+
C. AlO2- + 2H2O Al(OH)3 + OH- D. CO32-+H3O+ = H2O+HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关有机物水解的说法正确的是( )
A.纤维素水解的最终产物是葡萄糖B.蛋白质水解的最终产物是多肽
C.油脂的水解反应就是皂化反应D.有机物与水的反应都是水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)9.03×1023个CH4中,含____mol碳原子,___mol氢原子,___mol质子,____mol电子。与___个NH3含有相同数目的氢原子。
(2)与17gNH3所含有分子数相同的氧气的体积(标准状况)是_____L。
(3)某3.65g气体在标准状况下的体积是2.24L,则其摩尔质量是________。
(4)标准状况下9.03×1023个CH4所占的体积为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com