
科目: 来源: 题型:
【题目】某化学兴趣小组测定硫铁矿(主要成分FeS2)矿样中硫元素的质量分数,进行如下实验:将m1g样品放入如图所示装置C中,打开K1关闭K2,从a处不断通入空气,高温灼烧石英管中的样品。

请回答下列问题:
(1)装置B的名称为_____;a处不断通入空气的目的是_____。
(2)装置A的作用是_____。
(3)反应结束后,关闭K1打开K2,向烧瓶中加入液体,点燃G处酒精灯,使烧瓶中反应发生,操作流程如图。

①操作I所得溶液中所含的溶质有_____。
②操作Ⅱ是洗涤、烘干、称重,检验固体是否洗净的方法是_____。
③该硫铁矿中硫元素的质量分数为_____(用含m1、m2的代数式表示)
(4)取煅烧后的熔渣(含有Fe2O3、FeO),欲验证其中存在FeO,应选用的试剂是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是组成细胞的主要元素及其比例,根据图所示信息回答下列问题:
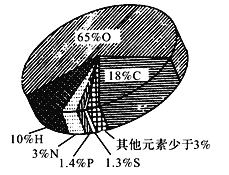
(1)构成细胞的主要元素有________。
(2)组成生物体的最基本元素占细胞鲜重的___________。
(3)硫元素主要存在于有机化合物的种类是___________。
(4)碳的含量没有氧多,为什么是最基本元素?_________________________________。
(5)C、H、N三种化学元素在干细胞中所占比例较高,而这三种元素在组成岩石圈的化学成分中,质量分数还不到1%,这个事实说明了______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要用逾。
(1)基态磷原子价电子排布的轨道表示式为_____。
(2)元素B、N、O的第一电离能由大到小的顺序为_____。
(3)一种食品添加剂NaNO2中NO2﹣中心原子的杂化类型是_____,与NO2﹣互为等电子体的分子的化学式为_____(写1种)
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_____,三溴化硼键角是_____。
②磷化硼晶体晶胞如图所示,其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,磷原子的配位数为是_____,该结构中有一个配位健,提供空轨道的原子是_____;已知该晶胞边长apm,阿伏加德罗常数为NA,则磷化硼晶体的密度为_____gcm﹣3。

查看答案和解析>>
科目: 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H =+41.3kJ·mol-1
CO(g)+H2O(g) △H =+41.3kJ·mol-1
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
①CO2加氢合成乙烯的热化学方程式为_____________________________。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是______(填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①能判断该反应达到化学平衡状态的是_______(填字母)。
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H______0(填“>”或“<”),图中压强p1____p2(填“>”或“<”)。
③经测定知Q点时容器的压强是反应前压强的9/10,则Q点H2的转化率为____________。
④N点时,该反应的平衡常数K=______(计算结果保留两位小数)。
(3)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机玻璃(聚甲基丙烯酸甲酯)具有透光率高、自重轻、安全性能高等优点,目前它广泛用于制作仪器仪表零件、照明灯罩、光学镜片、透明屋顶、电话亭、广告灯箱、标志牌等。
下图是以2—甲基丙烯为原料合成有机玻璃E(聚—2—甲基丙烯酸甲酯)的路线:

(1)有机化合物 中含有的官能团名称是_____________________________________。
中含有的官能团名称是_____________________________________。
(2)写出B的结构简式:___________________________________
(3)写出反应①的化学方程式____________________________________________________________________
(4)写出反应⑥的化学方程式__________________________________________________________________
(5)在上述① ~ ⑥反应中,属于取代反应的是______________,属于加成反应的是___________,
(6)写出E的结构简式:___________________________
(7)写出有机物 通过缩聚形成高分子聚酯F的结构简式:___________________________
通过缩聚形成高分子聚酯F的结构简式:___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题
(1)以电石制取乙炔时,用硫酸铜溶液除去其中的H2S气体,该反应方程式为____________________________
(2)在检验溴乙烷中的溴元素时,在加入NaOH溶液加热,冷却后,加入_______________________,若产生浅黄色沉淀,说明溴乙烷中含有溴元素。
(3)某同学设计了由乙醇合成乙二醇的路线如下。下列说法正确的是

步骤①的反应类型是________________________;步骤②需要的试剂是_________________________
(4)为了证明酸性:CH3COOH>H2CO3>C6H5OH,如图装置存在严重缺陷,请说明原因,并提出改进方案。

① 原因:______________________________________________________________
② 改进方案:___________________________________________________________
③ 改进后,装置乙中发生反应的化学方程式为:___________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室常用的装置,请根据要求回答问题:

(1)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为________________________,选用的气体发生装置是_________(填装置序号)。反应结束后,若要过滤分离出二氧化锰,除了玻璃棒外,还需要补充的玻璃仪器名称是__________、__________
(2)实验室可用碳酸钙固体与盐酸在常温下混合制取二氧化碳,选用的气体发生装置是________(填装置序号)。发生反应的化学方程式为:____________________________________
(3))下图中的C、D、E三种装置,均可用下图的F装置代替。若用F装置进行排空气法收集二氧化碳,二氧化碳应从F装置的_______(填“a”或“b”,下同)口通入;若用F装置进行排水法收集氧气,可先在F装置中装满水,然后将氧气从F装置的_______口通入。

(4)将二氧化碳通入紫色石蕊溶液中,溶液变成红色,加热后溶液又变成紫色。用化学方程式表示加热后溶液又变成紫色的原因是_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com