
科目: 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A.铅笔端作阳极,生成氢气B.铂片端作阴极,生成氯气
C.铅笔端有少量的氯气产生D.a点是负极,b点是正极
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H20=2Na0H+H2↑ B.C12+H20=HC1+HC10
C.2F2+2H20=4HF+02 D.2H20![]() 2H2↑+02↑
2H2↑+02↑
查看答案和解析>>
科目: 来源: 题型:
【题目】若某氧原子的质量是a g,12C原子的质量为b g,用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.氧元素的相对原子质量一定是12a/b
B.该氧原子的摩尔质量是![]()
C.W g该氧原子的物质的量一定是![]()
D.W g该氧原子所含的质子数是W/a个
查看答案和解析>>
科目: 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )的说法错误的是
)的说法错误的是
A. a、b、c互为同分异构体
B. a、c均能使酸性高锰酸钾溶液褪色
C. a、c与足量氢气反应消耗氢气的物质的量之比是4∶3
D. a、b、c的一氯代物分别有4种、1种、2种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作。回答下列问题:

(1)试剂Ⅰ的化学式为_______。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是除去A中的____,检验该离子已经除尽的方法是________________________________________________________。
(3)③中发生反应的化学方程式为_________________________________________________。
(4)由E得到KCl晶体的实验操作是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,含有相同氧原子数的![]() 与CO气体,下列叙述正确的( )
与CO气体,下列叙述正确的( )
A.物质的量之比为2:1B.体积之比为1:2
C.质量之比为16:7D.密度之比为7:16
查看答案和解析>>
科目: 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:

已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______________(任写一条);过滤1的滤渣的主要成分有__________(填化学式)。
(2)浸取时加入过量浓盐酸的目的是________________________________;“母液”中通入气体X后可循环利用,气体X为______________(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式_______________________________,当消耗标准状况下4.48 L O2时,转移电子的数目是__________。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当Pb2+恰好沉淀完全时,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
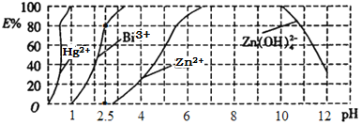
①当调节pH=2.5时,铋(Bi)的存在形式有________________________。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com