
科目: 来源: 题型:阅读理解
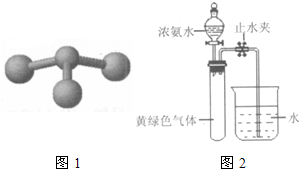 (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁

| ||
| ||
| 2 |
| 3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2010?西城区一模)下列实验操作不能达到其对应目的是( )
|
查看答案和解析>>
科目: 来源: 题型:
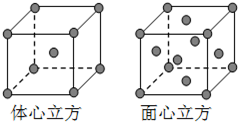 Fe为过渡元素,它的原子序数为26.回答下列问题:
Fe为过渡元素,它的原子序数为26.回答下列问题:查看答案和解析>>
科目: 来源: 题型:阅读理解
| 4xV2 |
| 27n2(1-x)4 |
| 4xV2 |
| 27n2(1-x)4 |
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com