
科目: 来源: 题型:
【题目】20℃时,NaCl溶解于水的实验数据如下表所示
实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
下列叙述正确的是( )
A. 实验①所得的溶液为饱和溶液 B. 实验②所得的溶液为饱和溶液
C. 20℃时NaCl的溶解度为30g D. 实验①所得溶液的溶质质量分数为16.7%
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下(20oC))课外小组用下列装置探究铁和硝酸反应情况,过程如下图所示:

将Ⅲ中液面上的气体排入小试管中点燃,有尖锐爆鸣声,小试管壁出现液滴。取反应后溶液,加入足量NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气带有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)X气体是______ (填化学式),证据是________。
(2)实验中硝酸被还原成另一种产物的化学方程式_____。
(3)甲同学对产生的气体原因提出假设并设计方案:
假设1:该浓度的硝酸中H+的氧化性大于NO3-
假设2:H+还原反应速率大于NO3-的还原反应速率
I. 验证假设1:可用____(选 “ Cu” 或“Zn”)粉与同浓度硝酸反应,依据 ____________ ,则假设1不成立。
II. 验证假设2:改变条件重复上图过程实验,结果如下:(所用试剂的量、气体成分与实验上图相同)
序号 | 反应温度 | 实验结果 |
a | 40oC | 溶液浅绿色,收集气体为3.4mL |
b | 60oC | 溶液浅绿色,收集气体为2.6mL |
上表实验结果_____(填“能”或“否”)判断假设2成立。由实验数据结果分析温度对铁粉与硝酸反应时对生成X体积的影响的原因___________。
(4)常温下(20℃),乙同学改用3mol·L–1 HNO3 进行图1过程实验,Ⅱ中仍为无色气体,在Ⅲ中气体变红色。由此得出的相关结论正确的是______ 。
a. 该实验产生的无色气体只有NO
b. 若改用浓硝酸时,反应会更剧烈还原产物为NO2
c. 硝酸的浓度不同时,其主要还原产物不同
(5)综上所述,金属与硝酸生成X气体,需要控制的条件是___________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)脱硝反应机理如图,Cu+的作用是____________,C2H4参与的反应方程式 ______________ 。
(2) 选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
① 其中被NO和O2氧化的NH3的比例 ________ 。
②该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是________ 。
③ 氨氮比 n(NH3)/n(NO) 会直接影响该方法的脱硝率。如图为350 ℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当 n(NH3)/n(NO) >1.0时,烟气中NO含量反而增大,主要原因是_________________________________。

(3) 烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
① ClO2在酸性条件下稳定,在NaOH溶液中可歧化为NaClO3和NaClO2,该反应的化学方程式为____。

② 某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是________;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
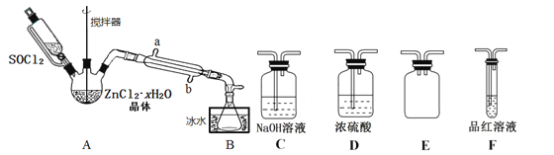
①用原理解释SOCl2在该实验中的作用:_________________________________。
②装置的连接顺序为A→B→______________________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
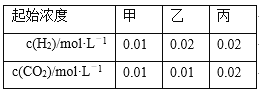
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 molL-1盐酸、0.55 molL-1NaOH溶液,实验尚缺少的玻璃用品是__、__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
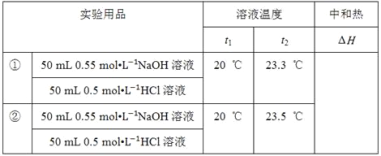
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J℃﹣1g﹣1,各物质的密度均为1 gcm﹣3。
① 计算完成上表ΔH=__(保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。
(4)若用KOH代替NaOH,对测定结果__(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果__(“有”或“无”)填影响。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已知可逆反应:M(g)+N(g) ![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列A、B、C、D是中学常见混合物分离或提纯的基本装置。请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。

(1)除去Ca(OH)2溶液中悬浮的CaCO3_________________;
(2)从碘水提取碘______________;
(3)用自来水制取蒸馏水_________________;
(4)分离植物油和水_____________;
(5)与海水晒盐原理相符的是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
查看答案和解析>>
科目: 来源: 题型:
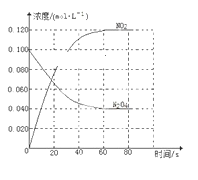
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如下图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T________(填“大于”或“小于”)100 ℃,判断理由是________________________________。
b.温度T时反应的平衡常数K2=____________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com