
科目: 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(![]() )配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
)配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
a.用量筒量取___________mL的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌.
b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入M里.
c.将稀释后的硫酸小心地用玻璃棒引流入M.
d.检查M是否发生滴漏.
e.将蒸馏水直接加入M,至液面接近刻度线2cm至3cm处.
f.盖紧瓶塞,反复倾倒振荡,摇匀溶液.
g.用________________向M里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.据此填写:
(1)正确的操作顺序是______.
(2)进行A步操作时,应量取______mL浓硫酸,选用量筒的规格是(填序号) _________.
a. 10mL b. 50mL c. 1000mL d. 1000mL
(3)配置上述溶液时,多次提到的实验仪器M是______________。步骤G中横线处是_________。
(4)进行A步骤操作时,必须_____后,才能进行后面的操作.
(5)实验操作中,下列操作会对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)
a.洗涤烧杯和玻璃棒的溶液未转入M中__________________
b.定容时,眼睛俯视溶液____________________
c.容量瓶中原残留少量蒸馏水__________________
d.定容后M中液面低于刻度线,又加水定容到刻度线.____________________
e量取浓硫酸时仰视量筒读数____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应的速率、限度及能量变化具有重要意义。
⑴实验室用锌粒和稀硫酸反应制氢气,能加快反应速率的方法有:______、______。
⑵工业上合成氨反应(N2+3H2![]() 2NH3)中物质的能量随时间的变化如下图所示。
2NH3)中物质的能量随时间的变化如下图所示。

①该反应为______(填“放热”或“放热”)反应。
②若起始N2和H2的体积比为1∶3,控制一定的条件,___(填“能”或“不能”)使反应物的转化率达到100%。
③下列过程放出热量的是______。(填字母)
A.甲烷燃烧
B.碳酸钙分解
C.液氨汽化
D.化学键断裂
⑶图为铜锌原电池示意图。

①原电池工作时的能量转化方式为______。
②原电池工作时,导线中电子的流向为______。
③Cu电极表面的现象为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体。

(1)该反应的化学方程式为_________________________________________________,氯化氢气体的发生装置应该选择装置___________(填装置的编号,下同)。由于氯化氢气体有害,所以实验室用装置D来收集氯化氢,收集氯化氢时,气体从________管(填“a”或“b”)进入。用水吸收多余的氯化氢气体时,应该选择装置__________,这是为了_________________________________________________。
(2)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个装置D,此时D中装入的液体应该是______________________。
(3)气体发生在装置的选择要考虑反应物状态和反应条件等因素。
实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置B,其原因分别是制取氧气时____________________________,制二氧化碳时___________________________。
(4)将标准状况下的200体积HCl气体溶于1体积水中,得到密度为1.12g/mL的盐酸,则该盐酸的物质的量浓度是_______________。 (保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A. 乙烯使酸性KMnO4溶液褪色
B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使溴的四氯化碳溶液褪色
D. 甲烷与氯气混合光照一段时间后黄绿色消失
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,是一种无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:

⑴从上述流程可以判断,滤液中可回收的主要物质是______。
⑵调pH时若条件控制不当,会使得所制的碱式次氯酸镁中混有Mg(OH)2杂质。为防止生成该杂质,实验中可以采取的方法是______。
⑶为测定碱式次氯酸镁的质量分数[含少量Mg(OH)2杂质],现进行如下实验:称取0.2000g碱式次氯酸镁样品,将其溶于足量硫酸。向溶液中加入过量KI,再用0.1000 mol·L-1 Na2S2O3滴定生成的I2,恰好完全反应时消耗Na2S2O3溶液体积为20.00 mL。计算碱式次氯酸镁的质量分数。(写出计算过程)______________
已知:2I-+ClO-+2H+=I2+Cl-+H2O,I2+2S2O32-=2I-+S4O62-。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:

阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。

②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
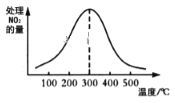
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。

(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为____________________________。
(2)如何用最简单的方法判断丙中是否成功制备出胶体?__________。
(3)向经过检验后的丙中逐滴加人盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是__________;
②随后发生变化得到和甲相同的溶液,此反应的离子方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com