
科目: 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】3-四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:

已知:① RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
② R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
③ R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
请回答下列问题:
(1)A生成B的反应类型是__________,B中含有的官能团是___________。
(2)D发生酯化反应生成E的化学方程式为___________。
(3)3-四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:______________________。
①能发生水解反应 ②分子中有3个甲基
(4)G的结构简式为__________。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:________。
(6)还可以利用![]() 与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
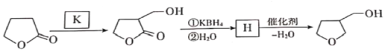
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组在常温下进行电解饱和Ca(OH)2溶液的实验,实验装置与现象见下表。
序号 | I | II |
装置 |
|
|
现象 | 两极均产生大量气泡,b极比a极多;a极溶液逐渐产生白色浑浊,该白色浑浊加入盐酸有气泡产生 | 两极均产生大量气泡,d极比c极多;c极表面产生少量黑色固体;c极溶液未见白色浑浊 |
下列关于实验现象的解释与推论,正确的是( )
A. a极溶液产生白色浑浊的主要原因是电解过程消耗水,析出Ca(OH)2固体
B. b极产生气泡:4OH- -4e- === O2↑ +2H2O
C. c极表面变黑:Cu -2e- +2OH- === CuO +H2O
D. d极电极反应的发生,抑制了水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学反应速率的说法中正确的是
A. 根据化学反应速率的大小可以知道化学反应进行的快慢
B. 化学反应速率为![]() ,是指1s时,物质的量深度为
,是指1s时,物质的量深度为![]()
C. 对任何化学反应来说,反应速率越大化学现象越明显
D. 化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列七种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有_____________,呈碱性的有____________
(2)分别写出②、④水解的离子方程式:_____________________________、_____________________________。
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_____________(填“相同”或“不相同”),溶液的PH:③_________⑥(填 >、=或 <)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如下:

依据实验下列说法不正确的是( )
A. 从上述实验可以得出海带中含有可溶性的含碘化合物
B. 步骤⑤中可能发生的反应为:5I- + IO3- +6H+ ===3I2 +3H2O
C. 若步骤④中用CCl4做萃取剂,步骤⑥应取上层溶液得到后续的混合物C
D. 整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 用过量氨水除去烟气中的二氧化硫:SO2 +2NH3·H2O === (NH4)2SO3+H2O
B. 呼吸面具中用过氧化钠吸收二氧化碳产生氧气:2Na2O2+2CO2 ===2Na2CO3+O2
C. 电解饱和氯化钠溶液产生气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D. 用浓硝酸除去试管内壁上附着的铜:8H+ +2NO3- +3Cu === 3Cu2+ +2NO↑ + 4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。

① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】固体表面的化学过程研究对于化学工业非常重要。在Fe催化剂、一定压强和温度下合成氨的反应机理如下图所示。下列说法不正确的是( )

A. N2和H2分子被吸附在铁表面发生反应
B. 吸附在铁表面的N2断裂了N≡N键
C. NH3分子中的N-H键不是同时形成
D. Fe催化剂可以有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com